Eletronegatividade é uma propriedade periódica representada pela letra grega χ, que mede o poder de atração que um átomo tem sobre os elétrons de uma ligação química. Consequentemente, serve para mostrar a tendência de um átomo a formar ânions. Tal conceito foi introduzido pelo químico norte-americano Linus Pauling, no ano de 1932, a partir das energias de dissociação de ligação, sendo aprimorado por diversos cientistas, destacando-se o também norte-americano Robert Mulliken.
Possui grande importância para os químicos na atualidade e vem sendo recalculada de diversas formas, mas sempre padronizada de acordo com a escala original de Pauling. Os halogênios são tidos como os elementos mais eletronegativos de cada período da Tabela Periódica, sendo o flúor o mais eletronegativo de todos. Há também o conceito da eletropositividade, não tão usado, que funciona como um conceito diametralmente oposto à eletronegatividade.
Leia também: Como são organizadas as famílias da Tabela Periódica?
Tópicos deste artigo
- 1 - Resumo sobre eletronegatividade
- 2 - Videoaula sobre eletronegatividade
- 3 - O que é eletronegatividade?
- 4 - Como encontrar a eletronegatividade de um elemento?
- 5 - Eletronegatividade segundo Robert Mulliken
- 6 - Eletronegatividade dos elementos na Tabela Periódica
- 7 - Variação de eletronegatividade na Tabela Periódica
- 8 - Diferenças entre eletronegatividade e eletropositividade
- 9 - Outras propriedades periódicas
- 10 - Exercícios resolvidos sobre eletronegatividade
Resumo sobre eletronegatividade
- A eletronegatividade é a capacidade de um átomo de atrair os elétrons de uma ligação química
- Consequentemente, também acaba por medir a tendência de um átomo em se tornar um ânion.
- Foi desenvolvida em 1932, pelo químico norte-americano Linus Pauling, a partir das energias de dissociação de ligação.
- Foi sendo aprimorada e recalculada por outros modelos, destacando-se o do cientista Robert Mulliken, de 1934, que utilizava valores de energia de ionização e afinidade eletrônica.
- Os halogênios são os elementos mais eletronegativos de cada período da Tabela Periódica, sendo o flúor o mais eletronegativo.
- A eletropositividade, embora menos usada, é um conceito diametralmente oposto à eletronegatividade.
Videoaula sobre eletronegatividade
O que é eletronegatividade?
A eletronegatividade é uma medida do poder de atração que um átomo tem sobre os elétrons da ligação química. Esse conceito foi introduzido em 1932 pelo químico norte-americano Linus Pauling.
Como encontrar a eletronegatividade de um elemento?
Pauling percebeu que as ligações covalentes polares apresentam energia de dissociação de ligação maior que as ligações covalentes apolares formadas a partir dos mesmos elementos. Por exemplo, a energia de dissociação da ligação HCl é igual a 432 kJ.mol-1, um valor superior à média aritmética entre as ligações H2 (436 kJ.mol-1) e Cl2 (243 kJ.mol-1).
A partir daí, Pauling definiu que a diferença de eletronegatividade (representada pela letra grega χ) entre dois elementos, hipoteticamente A e B, em elétron-volts, seria igual à raiz da diferença entre a energia de dissociação de ligação A─B e a média das ligações A─A e B─B:
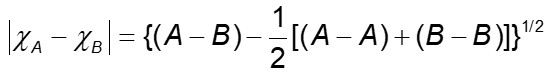
Foi a partir daí que Pauling obteve os primeiros valores de eletronegatividade, tão conhecidos por nós, como alguns dos listados a seguir:
|
Elemento |
Eletronegatividade de Pauling |
|
Hidrogênio, H |
2,1 |
|
Carbono, C |
2,5 |
|
Nitrogênio, N |
3,0 |
|
Fósforo, P |
2,1 |
|
Oxigênio, O |
3,5 |
|
Flúor, F |
4,0 |
Eletronegatividade segundo Robert Mulliken
Em 1934, outro químico norte-americano, Robert Mulliken, desenvolveu uma escala diferente de eletronegatividade, dessa vez baseada na média entre a energia de ionização (EI) e a afinidade eletrônica (AE) do elemento, ambas em elétron-volts:
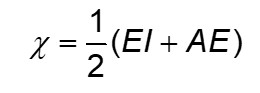
Os valores de Mulliken são coerentes com os valores obtidos por Pauling, o que auxiliou no andamento dessa grandeza. Posteriormente, diversos cientistas criaram novas escalas para o cálculo da eletronegatividade, englobando, inclusive, os gases nobres, que, aos poucos, foram também tendo seus compostos revelados. Contudo, as diversas escalas são ajustadas para dar valores próximos às de Pauling, considerada a principal e também a mais utilizada pelos químicos.
Veja também: Como é feita a distribuição eletrônica de íons?
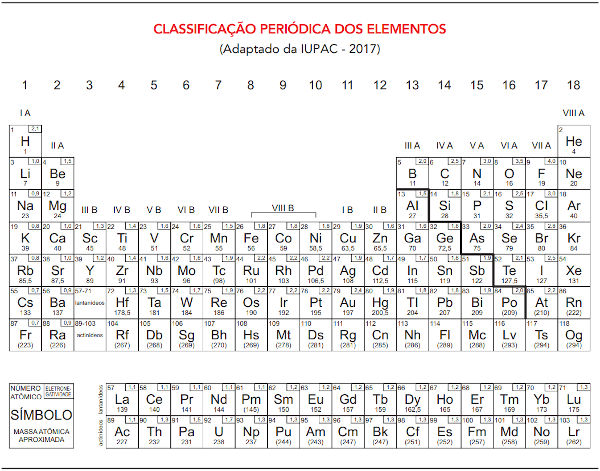
Eletronegatividade dos elementos na Tabela Periódica
Atualmente, os valores de eletronegatividade estão disponíveis em alguns modelos de Tabela Periódica. Para consultá-los corretamente, basta verificar a legenda da tabela. Um exemplo é a tabela da prova de vestibular da Universidade do Estado do Rio de Janeiro:
Variação de eletronegatividade na Tabela Periódica
A escala de Mulliken, que apresenta valores praticamente semelhantes aos de Pauling para eletronegatividade, é muito boa para justificar o comportamento da eletronegatividade dentro da Tabela Periódica. Recordemos que, segundo Mulliken, a eletronegatividade é calculada como:
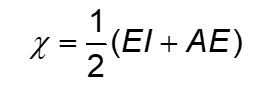
Assim sendo, quanto maior a energia de ionização (EI) e a afinidade eletrônica do átomo (AE), maior a eletronegatividade (χ). Recordemos também que a energia de ionização é a energia necessária para se retirar um elétron da camada de valência de um átomo isolado no estado gasoso. Quanto menor o raio atômico, mais atraídos estão os elétrons de valência, maior a energia de ionização.
Da mesma forma, a afinidade eletrônica é a variação de energia que ocorre quando um elétron se adiciona à camada de valência de um átomo isolado no estado gasoso. Quanto mais energia for liberada, mais favorável é o processo, maior é a afinidade eletrônica. Átomos menores e prestes a formar octeto possuem maior afinidade eletrônica.
Assim, é esperado que átomos muito eletronegativos sejam aqueles que possuam raio pequeno e estejam próximos a completar o octeto, características que aumentam a energia de ionização e a afinidade eletrônica. Quem combina essas duas características é o flúor, não à toa o elemento mais eletronegativo da Tabela Periódica. Por isso, percebe-se que quanto mais acima e mais à direita da tabela, maior a eletronegatividade.

Diferenças entre eletronegatividade e eletropositividade
Eletronegatividade e eletropositividade, em Química, são conceitos antagônicos. Ou seja, um elemento, se pouco eletronegativo, é muito eletropositivo. Assim sendo, enquanto os ametais são conhecidos pela sua alta eletronegatividade, os metais são conhecidos pela sua alta eletropositividade, de modo geral.
Os elementos eletronegativos possuem tendência a formar ânions, enquanto os eletropositivos possuem tendência a formar cátions, pois os primeiros têm alta energia de ionização e alta afinidade eletrônica, enquanto os outros possuem baixa energia de ionização e baixa afinidade eletrônica. Por serem propriedades opostas é que dificilmente ambas são citadas, sendo necessário apenas falar sobre a eletronegatividade.
Saiba mais: Como descobrir a camada de valência de um átomo?
Outras propriedades periódicas
- Raio atômico: propriedade periódica utilizada para dimensionar o tamanho de um átomo. O raio de um átomo é equivalente à metade do comprimento da ligação de sua substância simples.
- Energia de ionização: é a energia necessária para se retirar um elétron de valência de um átomo isolado no estado gasoso.
- Afinidade eletrônica: é a variação de energia que ocorre quando um elétron é adicionado à camada de valência de um átomo isolado no estado gasoso. Quanto mais energia for liberada, mais favorável é o processo.
Exercícios resolvidos sobre eletronegatividade
Questão 1
(Unioeste-PR 2013)
A eletronegatividade é uma propriedade física que mede a tendência que um átomo possui em atrair elétrons compartilhados em uma ligação química. Com relação às propriedades físicas dos elementos químicos, pode-se afirmar que a resposta correta é:
a) O raio atômico de um átomo é inversamente proporcional à eletronegatividade.
b) A energia de ionização e a eletronegatividade de um átomo são diretamente proporcionais.
c) Os gases nobres são os elementos químicos que apresentam os maiores valores de eletronegatividade.
d) Os elementos da família 1A são os que apresentam maior eletronegatividade e menor eletropositividade.
e) A afinidade eletrônica mede a tendência de um átomo em receber um elétron na sua eletrosfera, por isso quanto maior for essa propriedade menor será a eletronegatividade.
Resposta:
Letra A.
Quanto menor for o raio atômico, maiores serão a energia de energia de ionização (o elétron de valência está mais atraído pelo núcleo em átomos pequenos) e a afinidade eletrônica (o elétron, ao ser adicionado, sente mais a atração do núcleo). Pela série de Mulliken, que apresenta valores semelhantes à de Pauling, a eletronegatividade é diretamente proporcional a essas duas propriedades periódicas. Assim sendo, quanto menor o raio atômico, maior a eletronegatividade, ou seja, raio atômico e eletronegatividade são inversamente proporcionais.
Questão 2
(PUC-RS 2015)
INSTRUÇÃO: Para responder à questão, analise o quadro a seguir, que apresenta os valores de eletronegatividades de elementos químicos representativos.
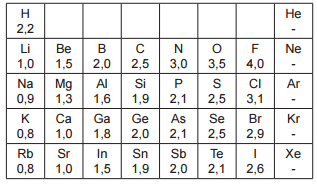
Em relação ao quadro apresentado, é correto afirmar que
a) Os valores de eletronegatividade dos metais alcalinos são inferiores aos dos gases nobres.
b) Os halogênios geralmente apresentam forte tendência de atrair elétrons em ligações covalentes e podem formar ânions.
c) Os elementos que possuem dois níveis de energia apresentam menores eletronegatividades.
d) As eletronegatividades dos elementos do grupo do carbono decrescem regularmente em função do crescimento do número atômico.
e) Os elementos boro, germânio e antimônio apresentam igual eletronegatividade em razão de terem mesmo número de elétrons no nível de valência.
Resposta:
Letra B
O grupo dos halogênios (F, Cl, Br e I), segundo o quadro, são os que apresentam, a cada período, os maiores valores de eletronegatividade. A eletronegatividade é, justamente, a tendência em atrair elétrons em ligações covalentes e, consequentemente, a de formar ânions.
Créditos da imagem
Por Stéfano Araújo Novais
Professor de Química




