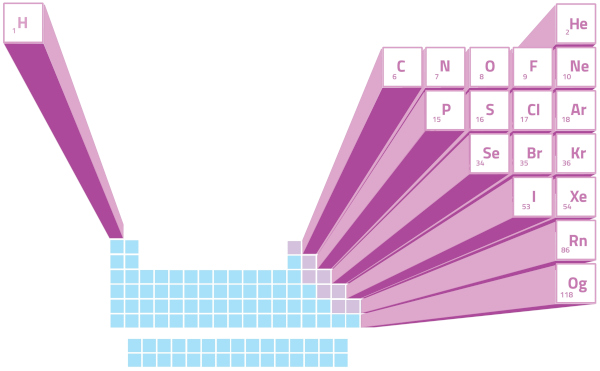
Os ametais (ou não metais) são uma categoria de elementos químicos que exibem propriedades distintas em comparação aos metais. São caracterizados principalmente por serem maus condutores de calor e de eletricidade, serem quebradiços e tenderem a ganhar elétrons. São eles os seguintes:
-
carbono (C);
-
nitrogênio (N);
-
fósforo (P);
-
oxigênio (O);
-
enxofre (S);
-
selênio (Se);
-
flúor (F);
-
cloro (Cl);
-
bromo (Br);
-
iodo (I);
-
astato (At);
-
hélio (He);
-
neônio (Ne);
-
argônio (Ar);
-
criptônio (Kr);
-
xenônio (Xe);
-
radônio (Rn);
-
oganessônio (Og);
-
hidrogênio (H).
É interessante notar que muitos dos elementos essenciais para a vida na Terra são ametais. O carbono, por exemplo, é a base de todas as moléculas orgânicas, enquanto o oxigênio é vital para a respiração celular. Já o nitrogênio é um componente fundamental das proteínas e do DNA. De um modo mais geral, os ametais possuem diversas aplicações.
Leia também: O que são os metais?
Tópicos deste artigo
- 1 - Resumo sobre os ametais
- 2 - Videoaula sobre os ametais
- 3 - Quais são os ametais?
- 4 - Propriedades dos ametais
- 5 - Características dos ametais
- 6 - Ametais na tabela periódica
- 7 - Qual a aplicação dos ametais?
- 8 - Ligações químicas dos ametais
- 9 - Diferenças entre ametais, metais e semimetais
- 10 - Exercícios resolvidos sobre ametais
Resumo sobre os ametais
-
Os ametais são uma categoria de elementos químicos caracterizados principalmente por serem maus condutores de calor e de eletricidade e tenderem a ganhar elétrons.
-
Encontram-se principalmente no lado direito da tabela e incluem elementos dos grupos 14 a 18.
-
Podem ser sólidos, líquidos ou gasosos à temperatura ambiente.
-
Geralmente possuem baixos pontos de fusão e ebulição, baixa densidade comparada aos metais e são maus condutores de calor e eletricidade.
-
Não são maleáveis nem dúcteis, tendem a ser quebradiços.
-
Apresentam altas eletronegatividade e afinidade eletrônica.
-
Possuem tendência a formar compostos covalentes e iônicos (ânions ao ganhar elétrons).
-
Podem atuar como agentes oxidantes e alguns são altamente reativos, especialmente os halogênios.
-
Os ametais possuem importantes aplicações:
-
carbono é essencial para todos os compostos orgânicos;
-
nitrogênio é utilizado na produção de amônia e fertilizantes;
-
oxigênio é essencial para a respiração e a combustão;
-
flúor é utilizado na produção de fluoretos para prevenção de cáries, Teflon e gases refrigerantes;
-
fósforo é usado em fertilizantes, produção de aço e fósforos;
-
enxofre é importante na produção de ácido sulfúrico, vulcanização de borracha, fungicidas;
-
cloro tem aplicação em desinfetantes, PVC e branqueamento;
-
bromo é usado em retardantes de chama, fotografia e tratamento de água;
-
iodo tem uso na medicina, é usado como suplemento alimentar e na produção de corantes;
-
selênio está na eletrônica, vidraria e nutrição;
-
astato possui aplicações na medicina nuclear e em pesquisas científicas;
-
hidrogênio tem utilidades como combustível, na produção de amônia e uso na refinaria de petróleo.
-
Videoaula sobre os ametais
Quais são os ametais?
Os ametais incluem elementos dos grupos 14 a 18, ou seja, distribuem-se em diferentes períodos e grupos na tabela periódica, abrangendo desde o carbono até o radônio:
-
Grupo 14: carbono (C).
-
Grupo 15: nitrogênio (N), fósforo (P).
-
Grupo 16: oxigênio (O), enxofre (S), selênio (Se).
-
Grupo 17 (halogênios): flúor (F), cloro (Cl), bromo (Br), iodo (I), astato (At).
-
Grupo 18 (gases nobres): hélio (He), neônio (Ne), argônio (Ar), criptônio (Kr), xenônio (Xe) e radônio (Rn); pouco se sabe sobre o oganessônio (Og).
-
Hidrogênio (H): mesmo estando localizado no grupo 1 (metais alcalinos), o hidrogênio apresenta características de ametal.
Embora os gases nobres possuam algumas características que podem diferi-los de outros ametais, como sua reatividade extremamente baixa, eles são classificados como ametais devido às suas propriedades de condução, estados físicos e comportamento químico que se alinham mais com os ametais do que com os metais.
Propriedades dos ametais
No que tange as propriedades dos ametais, podemos destacar as físicas e químicas, as quais caracterizam os elementos pertencentes a essa classe.
→ Propriedades físicas dos ametais
-
Estados da matéria: podem ser encontrados nos estados sólido, líquido ou gasoso à temperatura ambiente, como é o caso do carbono, bromo e oxigênio, respectivamente.
-
Ponto de fusão e ebulição: geralmente possuem pontos de fusão e ebulição mais baixos em comparação com os metais, com exceção apenas do carbono diamante, cujo ponto de fusão é muito alto.
-
Densidade: a densidade dos ametais tende a ser menor do que a dos metais.
-
Condutividade térmica e elétrica: são maus condutores de calor e eletricidade.
-
Maleabilidade e ductilidade: não são maleáveis nem dúcteis, tendem a ser quebradiços quando sólidos.
→ Propriedades químicas dos ametais
-
Eletronegatividade: possuem alta eletronegatividade, ou seja, tendem a atrair elétrons em ligações químicas. O flúor, por exemplo, tem a maior eletronegatividade entre os elementos.
-
Afinidade eletrônica: geralmente possuem alta afinidade eletrônica, liberando energia ao ganhar um elétron.
-
Energia de ionização: possuem altas energias de ionização, refletindo sua resistência a perder elétrons.
-
Reatividade: muitos ametais são altamente reativos, especialmente os halogênios e o oxigênio, isto é, reagem vigorosamente com a maioria dos elementos.
-
Ligações químicas: formam principalmente ligações covalentes ao compartilharem elétrons.
-
Oxidação e redução: podem atuar como agentes oxidantes, sendo reduzidos ao ganhar elétrons, como é o caso do oxigênio, que é um agente oxidante comum, formador de óxidos.
Características dos ametais
Os ametais apresentam características bem diversificadas, sendo algumas delas diferentes para cada tipo de elemento. Por exemplo, em relação às cores, o enxofre é amarelo, enquanto o fósforo pode ser branco ou vermelho; o gás oxigênio, incolor; o carbono grafite é opaco. Além disso, a alotropia é outro fator marcante para alguns desses elementos, ou seja, a mesma substância pode existir em formas distintas, como é caso do carbono, que pode ser encontrado como diamante, grafite e fulerenos. Nesse contexto, outras características marcantes são as seguintes:
-
Frequentemente reagem com metais para formar sais. Um exemplo clássico é o cloro, que reage com o sódio para formar cloreto de sódio (sal de cozinha).
-
São tipicamente isolantes, não permitindo a passagem fácil de eletricidade ou calor. O enxofre, por exemplo, é um excelente isolante térmico.
-
A solubilidade em água varia muito. Por exemplo, enquanto o cloro é solúvel em água, o enxofre não é.
Veja também: O que são os semimetais?
Ametais na tabela periódica
Primeiro, devemos entender que, na tabela periódica, para um elemento ser caracterizado como metal é necessário levar em consideração o seu caráter metálico, mas o que seria isso? Consiste nas propriedades características dos metais, como a tendência de perder elétrons, brilho metálico, alta condutividade térmica e elétrica, maleabilidade e ductilidade. Ou seja, quanto menor for o valor desse parâmetro, menos características de metal terá o elemento e maior “caráter ametálico” ele terá.
Sendo assim, para os ametais, as características devem ser o inverso dos metais: tendência de ganhar elétrons, alta eletronegatividade, baixa condutividade térmica e elétrica, e fragilidade no estado sólido, isto é, conforme nos movemos da esquerda para a direita em um período da tabela, o caráter ametálico dos elementos aumenta. Isso ocorre porque os elementos à direita tendem a ganhar elétrons com mais facilidade devido à sua alta eletronegatividade. Sendo assim, podemos ilustrar isso da seguinte forma:
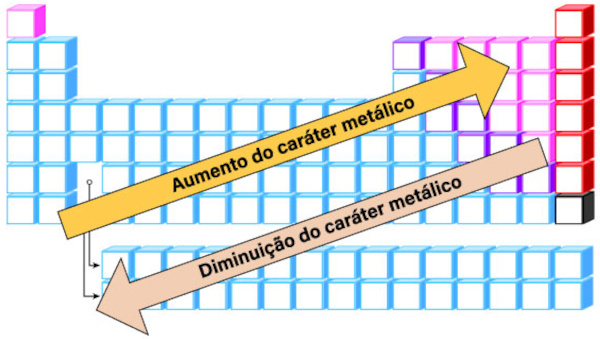
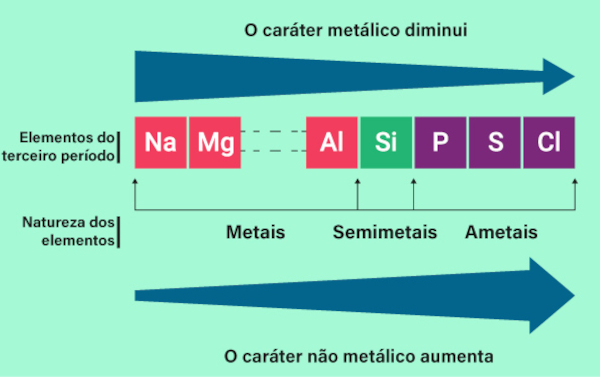
Para fins de comparação, podemos notar o contraste entre os extremos da tabela. Por exemplo, no período 3, o sódio (Na) é um metal, enquanto o cloro (Cl) é um ametal com propriedades fortemente ametálicas.
Em contrapartida, conforme nos movemos de cima para baixo em um grupo da tabela periódica, o caráter ametálico diminui, pois os átomos ficam maiores e os elétrons na camada de valência estão mais afastados do núcleo, tornando-os menos atraídos por novos elétrons. Por exemplo, no grupo 17, o flúor (F) no topo é mais ametálico comparado ao iodo (I) na parte inferior.
|
F |
|
|
Cl |
|
|
Br |
|
|
I |
Nesse contexto, vale destacar alguns fatores. Eletronegatividade, energia de ionização e afinidade eletrônica influenciam no caráter ametálico dos elementos, uma vez que as três propriedades aumentam da esquerda para a direita em um período e diminuem de cima para baixo em um grupo de forma análoga ao caráter ametálico.
Qual a aplicação dos ametais?
Alguns ametais servem como combustíveis e podem reagir rapidamente com o oxigênio, liberando energia; por exemplo, o fósforo reage vigorosamente com o oxigênio. Nesse contexto, com exceção dos gases nobres, veja abaixo as principais aplicações dos ametais:
-
Carbono: essencial para todos os compostos orgânicos e para a vida. O diamante (uma forma de carbono) é usado em joalheria e em ferramentas de corte, enquanto o grafite é usado em lápis e como lubrificante.
-
Nitrogênio: utilizado na produção de amônia para fertilizantes, e na fabricação de explosivos e polímeros.
-
Oxigênio: essencial para a respiração e a combustão. Utilizado na produção de aço e em tratamentos médicos.
-
Flúor: usado na produção de fluoretos para a prevenção de cáries dentárias e na fabricação de Teflon.
-
Fósforo: utilizado em fertilizantes, detergentes e fogos de artifício.
-
Enxofre: importante na produção de ácido sulfúrico, que é usado em baterias e na indústria química.
-
Cloro: usado na purificação da água, na fabricação de plásticos (PVC) e em produtos de limpeza.
-
Selênio: é usado em células fotovoltaicas, como semicondutor e em vidros para remover a cor verde causada pelo ferro, além de ser importante em pequenas quantidades na dieta humana e animal.
-
Bromo: possui aplicação na produção de retardantes de chama em materiais plásticos e têxteis, em filmes fotográficos e no tratamento de água.
-
Iodo: é usado como antisséptico, contrastes para exames de imagem, suplemento de iodo em sal para prevenir deficiência e na produção de corantes e tintas.
-
Astato: tem aplicação na radioterapia para o tratamento de câncer e em pesquisas científicas.
-
Hidrogênio: utilizado em células de combustível para carros e outras aplicações energéticas, produção de amônia e na hidrogenação de combustíveis fósseis.
Ligações químicas dos ametais
Quanto aos tipos de ligações químicas, os ametais são bem versáteis, ou seja, tendem a formar compostos covalentes ao compartilhar elétrons com outros ametais (ametal-ametal) ou consigo mesmos, ou frequentemente ganham elétrons para formar íons negativos (ânions) em ligações iônicas (metal-ametal). Sendo assim, podemos destacar:
-
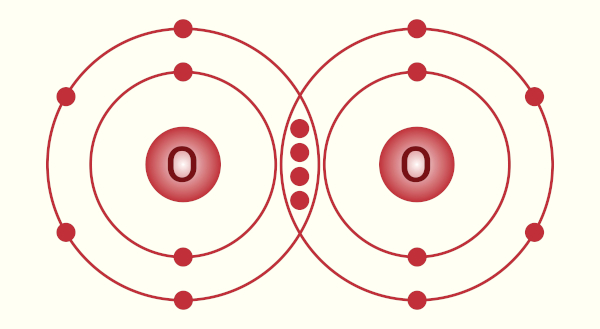
Ligações covalentes (ametal-ametal): a característica mais notável dos ametais é a tendência de formar ligações covalentes, e isso ocorre porque eles geralmente possuem altas eletronegatividades, o que significa que atraem fortemente os elétrons para si. Por exemplo, no caso do o O2, dois átomos de oxigênio compartilham dois pares de elétrons, formando uma ligação dupla, a qual é forte e estável, permitindo que cada átomo de oxigênio alcance a configuração eletrônica do neônio.
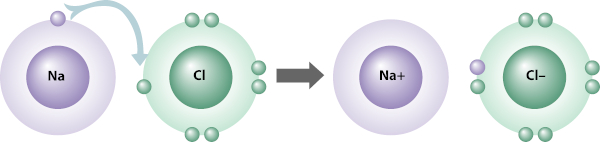
- Ligações iônicas (metal-ametal): embora menos comuns, os ametais também podem participar de ligações iônicas, especialmente quando reagem com metais. Nesse caso, um átomo perde elétrons e outro ganha esses elétrons, resultando na formação de íons positivos (cátions) e negativos (ânions), respectivamente. Os ametais, devido à sua alta eletronegatividade, tendem a ganhar elétrons e formar ânions. Por exemplo, o cloro (um ametal) reage com o sódio (um metal) para formar cloreto de sódio (NaCl). O sódio perde um elétron para formar um cátion sódio (Na⁺), enquanto o cloro ganha esse elétron para formar um ânion cloreto (Cl⁻). A atração eletrostática entre esses íons opostos resulta em uma ligação iônica forte e na formação de um composto estável.
Diferenças entre ametais, metais e semimetais
É importante saber diferenciar os ametais dos metais e semimetais, porquanto possuem propriedades distintas que influenciam seu comportamento físico e químico. Em vista disso, enquanto os ametais são maus condutores, quebradiços e tendem a ganhar elétrons, os metais, por outro lado, são bons condutores, maleáveis e tendem a perder elétrons. Já os semimetais, atualmente conhecidos como metaloides, possuem propriedades intermediárias. Para fins de comparação, veja no quadro a seguir as principais características dessas classes:
|
Propriedade |
Metais |
Ametais |
Semimetais |
|
Condutividade |
alta (elétrica e térmica) |
baixa |
moderada (semicondutores) |
|
Maleabilidade/ductilidade |
alta |
baixa (quebradiços) |
intermediária (quebradiços) |
|
Brilho |
lustroso |
opaco ou translúcido |
lustroso |
|
Estado físico |
sólido (exceto mercúrio) |
sólido, líquido, gasoso |
sólido |
|
Reatividade |
perde elétrons (forma cátions) |
ganha elétrons (forma ânions) |
pode ganhar ou perder elétrons |
Exercícios resolvidos sobre ametais
Questão 1
(Univesp) As substâncias químicas diariamente utilizadas são compostas por átomos. Esses átomos podem estar ligados entre si através de ligações químicas. Considere os três tipos de ligação química: iônica, covalente e metálica, e assinale a alternativa correta.
A) A ligação iônica ocorre entre dois átomos de ametais, onde há a transferência de elétrons de um átomo para outro, tornando a molécula polar
B) A ligação covalente ocorre entre átomos de ametais através do compartilhamento de elétrons. Se um átomo é mais eletronegativo, esse átomo atrai esse(s) elétron(s) compartilhado(s) com uma força menor e, assim, a molécula é polar
C) A ligação metálica ocorre entre os átomos de metais. Esses átomos se unem através da transferência de elétrons de um átomo para o outro, chamados de cátion e ânion
D) A ligação iônica ocorre entre átomos de metais e átomos de ametais. Os cátions apresentam carga positiva enquanto os ânions apresentam carga negativa. Na ligação iônica, o cátion doa seu(s) elétron(s) para o ânion, formando assim um composto iônico estável com carga elétrica neutra
E) Na ligação covalente entre os átomos, o átomo de maior eletronegatividade doa seu elétron para o átomo com menor eletronegatividade, obtendo-se, assim, uma molécula apolar
Resolução:
Alternativa D.
Vamos analisar cada caso:
A) A ligação iônica ocorre entre átomos de metais e ametais, onde há a transferência de elétrons de um átomo para outro. Não possui caráter molecular.
B) A ligação covalente ocorre entre átomos de ametais através do compartilhamento de elétrons. Se um átomo é mais eletronegativo, esse átomo atrai esse(s) elétron(s) compartilhado(s) com uma força maior e, assim, a molécula é polar.
C) Na ligação metálica não há ânions, mas sim cátions dos metais e uma nuvem de elétrons migrando entre os átomos.
D) Correto. A ligação iônica de fato ocorre entre um metal e um ametal formando um composto neutro.
E) Não há transferência de elétrons em ligações covalentes.
Questão 2
(Uniredentor – adaptada) As propriedades periódicas correspondem àquelas que se repetem periodicamente na tabela periódica, ou seja, tem valores semelhantes em intervalos regulares, à medida que o número atômico aumenta. Um exemplo de propriedade periódica é a eletronegatividade, que é relacionada à força de atração exercida sobre elétrons de uma ligação e influencia no caráter metálico das substâncias. Entre os elementos abaixo, assinale a alternativa com aquele que possui maior caráter ametálico:
A) flúor.
B) bromo.
C) hidrogênio.
D) lítio.
E) magnésio.
Resolução:
Alternativa A.
Vale lembrar que o caráter ametálico aumenta da esquerda para a direita e de baixo para cima na tabela periódica. Portanto, dentre os elementos listados, o flúor é o que apresenta maior eletronegatividade, ou seja, possui uma grande capacidade de atrair elétrons. Consequentemente, isso faz com que ele tenha um maior caráter ametálico em relação aos demais elementos, pois se encontra no canto superior direito da tabela.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. As propriedades gerais dos elementos. In: Princípios de Química: Questionando A Vida Moderna e o Meio Ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 60–61.
BROWN, T. L. et al. Metais, não metais e metaloides. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 287–292.
FELTRE, R. A classificação periódica moderna. In: Química Geral. v. 1. 6. ed. São Paulo: Moderna, 2004. p. 113–116.
REIS, M. Classificação dos elementos. In: Química 1 - Ensino Médio. v. 1. 1. ed. São Paulo: Editora Ática, 2013. p. 205–207.