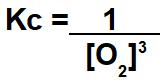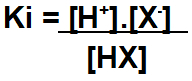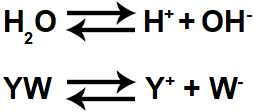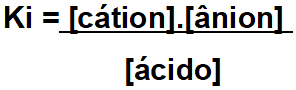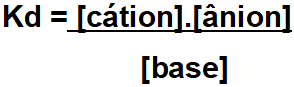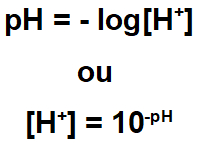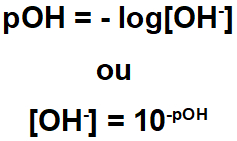Equilíbrio químico é o nome dado ao ramo da Físico-Química que estuda toda e qualquer reação reversível, na qual existem duas reações possíveis, uma direta (em que os reagentes transformam-se em produtos) e uma inversa (em que os produtos transformam-se em reagentes). Essas reações apresentam a mesma velocidade.
\(Vd = Vi\\ A+B \rightleftharpoons C+D\)
Tópicos deste artigo
- 1 - Resumo de equilíbrio químico
- 2 - Introdução sobre equilíbrio químico
- 3 - Condições para ocorrência de um equilíbrio químico
- 4 - Mapa mental: Equilíbrio químico
- 5 - Gráfico de equilíbrio químico
- 6 - Exemplos de equilíbrios químicos
- 7 - Constante de equilíbrio químico em termos de concentração
- 8 - Constante de equilíbrio químico em termos de pressão
- 9 - Grau de equilíbrio
- 10 - Constante de ionização
- 11 - Constante do produto de solubilidade
- 12 - Deslocamento de equilíbrio (Princípio de Le Chatelier)
- 13 - Casos particulares
- 14 - Fórmulas utilizadas no equilíbrio químico
- 15 - Exercício sobre equilíbrio químico no Enem
Resumo de equilíbrio químico
-
Velocidade da reação direta é sempre igual à da inversa.
-
Graficamente, é detectado quando as curvas passam a ser constantes em relação ao eixo y.
-
Podem ter participantes gasosos, líquidos, aquosos ou sólidos.
-
Pode ser calculado em relação à concentração (mol/L), à pressão parcial ou ao número de íons.
-
De acordo com o estudo da quantidade de cátions hidrônio e hidróxido, os meios podem ser classificados em ácidos, básicos ou neutros.
-
Quando envolve a dissolução de um sal em água, a constante de equilíbrio passa a envolver a hidrólise salina.
-
Se a solução é formada por ácido ou base fraca, juntamente com um sal, forma-se uma solução-tampão.
Introdução sobre equilíbrio químico
Toda reação química possui uma velocidade. No caso das reações reversíveis, a reação direta tem a sua, enquanto a indireta tem a dela. O processo só entrará em equilíbrio químico quando as duas velocidades tornarem-se absolutamente iguais.
\(Vd = Vi\\ A+B \rightleftharpoons C+D\)
Condições para ocorrência de um equilíbrio químico
Conforme exposto, um equilíbrio químico só ocorrerá:
-
Se a reação for reversível;
-
Quando a velocidade da reação direta for igual à da reação inversa;
-
Se a reação ocorrer em ambiente fechado (no caso de gases).
Mapa mental: Equilíbrio químico
.jpeg)
*Baixe o mapa mental sobre equilibrio químico!
Gráfico de equilíbrio químico
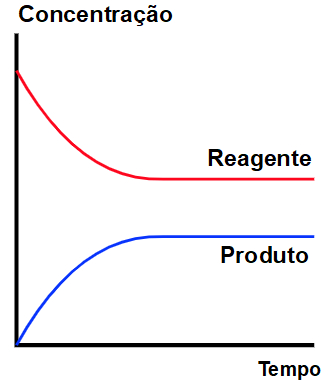
O gráfico de equilíbrio químico apresenta sempre as mesmas variáveis: tempo, no eixo x, e concentração em mol/L, no eixo y. Qualquer curva descendente pertence a um reagente, e qualquer curva ascendente pertence a um produto.
Variáveis de um gráfico de equilíbrio químico.
Identificamos uma situação de equilíbrio quando as curvas presentes no gráfico tornam-se horizontais em relação ao eixo da concentração.
Situação de equilíbrio em um gráfico.
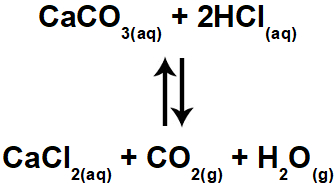
Exemplos de equilíbrios químicos
Abaixo, seguem exemplos de equilíbrios químicos:
Exemplo 1: Equilíbrio gasoso.
Exemplo 2: Equilíbrio com participante sólido.
Exemplo 3: Equilíbrio com participante dissolvido em água (meio aquoso).
Exemplo 4: Equilíbrio com participante líquido.
Constante de equilíbrio químico em termos de concentração
Constante de equilíbrio em termos de concentração (mol/L) ou simplesmente Kc é a relação estabelecida entre as concentrações molares de produtos e de reagentes presentes em uma reação elevadas aos seus respectivos expoentes.
Observe o seguinte equilíbrio:
O Kc desse equilíbrio terá no numerador a multiplicação entre as concentrações dos produtos (C e D). No denominador, teremos a multiplicação entre as concentrações dos reagentes (A e B). Todos as concentrações deverão ser elevadas aos seus respectivos coeficientes estequiométricos (a, b, c, d).
Agora, observe o equilíbrio com participantes gasosos abaixo:
A expressão da constante de equilíbrio (Kc) para essa reação será:
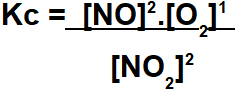
Expressão do Kc do equilíbrio.
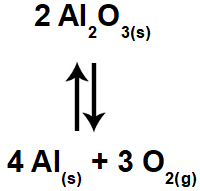
Obs.: os participantes no estado sólido são sempre constantes, por isso, não participam da expressão do Kc.
Como o Al2O3 e o Al são sólidos, não entrarão na expressão do Kc. Em suas posições, colocamos o número 1.
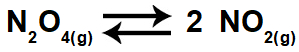
Exemplo: Em determinadas condições de temperatura e pressão, existe 0,5 mol/L de N2O4 em equilíbrio com 2,0 mols/ L de NO2, segundo a reação abaixo:
A constante de equilíbrio (Kc) desse equilíbrio, nas condições da experiência, será numericamente igual a:
a) 0,125
b) 0,25
c) 1
d) 4
e) 8
Para fazermos os cálculos, colocamos os valores das concentrações de cada um dos participantes na expressão do Kc:
Kc = [NO2]2
[N2O4]
Kc = (2)2
0,5
Kc = 8 mol/L
Resposta: Letra e
Constante de equilíbrio químico em termos de pressão
A constante de equilíbrio em termos de pressão parcial é representada pela sigla Kp e é determinada quando pelo menos um dos componentes do equilíbrio, seja ele reagente ou produto, está no estado gasoso.
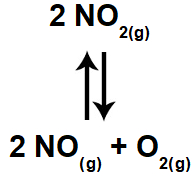
Equação de reação com componente gasoso.
Para expressar a constante Kp desse equilíbrio, seguimos o mesmo princípio da determinação do Kc, ou seja, produtos no numerador e reagentes no denominador.
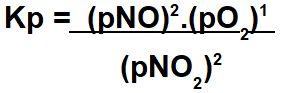
Expressão do Kp do equilíbrio gasoso.
O cálculo da expressão do equilíbrio Kp segue como realizado anteriormente com o Kc. A única diferença é que utilizamos as pressões parciais dos participantes em vez de usarmos a concentração em mol/L.
Grau de equilíbrio
Representado pela sigla α, o grau de equilíbrio indica a quantidade, em porcentagem (%), de matéria do reagente que reagiu durante a reação. Para calculá-lo, devemos utilizar a seguinte expressão:
O resultado do grau de equilíbrio deve ser sempre multiplicado por 100 para que seja transformado em porcentagem.
Exemplo: Aqueceram-se 2 mol de PCℓ5 em um recipiente fechado com capacidade de 2 L. Atingindo o equilíbrio, o PCℓ5 estava 40% dissociado em PCℓ3 e Cℓ2. Calcule a constante de equilíbrio.
A equação que representa o equilíbrio é:
O enunciado indica que foram adicionados 2 mol de PCl5 em um recipiente de 2L. Logo, sua concentração é de 1 mol/L.
Se, inicialmente, havia 1 mol/L, e 40% (0,4) dele foi dissociado:
α = Concentração que reagiu
Concentração inicial
0,4 = Concentração que reagiu
1
Concentração que reagiu = 0,4 mol/L
De acordo com a equação, a estequiometria dela é de 1:1:1. Logo, o que reage é o que forma no produto. Assim, foram formados 0,4 mol/L de PCl3 e 0,4 mol/L Cl2. Com relação ao PCl5 é diferente: no início tínhamos 1 mol/L e reagiu 0,4 mol/L. Logo, sobraram 0,6 mol/L.
Por fim, basta utilizarmos os valores para realizar o cálculo do Kc:
Kc = [PCl3].[Cl2]
[PCl5]
Kc = 0,4 . 0,4
0,6
Kc = 0,26 mol/L (aproximadamente)
Constante de ionização
A constante de ionização (representada pelas siglas Ki, Ka, Kb, Kd) é a relação estabelecida entre eletrólito (ácido ou base) dissolvido em água e os íons liberados.
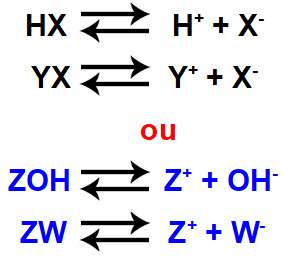
Quando um ácido (HX) é dissolvido em água, sofre ionização, produzindo o cátion hidrônio (H+) e um ânion (X-) qualquer:
![]()
Equação representando a ionização de um ácido.
A expressão do Ki para esse ácido é:
Obs.: quanto maior for o valor da constante, mais forte ele é.
Constante do produto de solubilidade
Essa constante, representada por Kps ou Ks, está relacionada com a dissolução de sais muito pouco solúveis em água. Quando um sal (YX) de baixa solubilidade está em água, uma pequena parte dele dissolve-se, dissociando-se. Forma-se, então, um equilíbrio químico entre os íons liberados e os cristais do eletrólito (sal).
Para determinar a expressão do Kps, utiliza-se apenas o produto da concentração em mol/L dos íons (cátion Y+ e ânion X-), já que a maior parte do eletrólito está no estado sólido, o qual não participa de uma constante.
Exemplo: O produto de solubilidade (Kps) do Pb(OH)2 é dado pela expressão:
a) Kps = [Pb2+][OH–]2
b) Kps = [Pb2+]2 [OH–]
c) Kps = [Pb(OH)2]
d) Kps = [Pb2+] + [OH–]2
e) Kps = [Pb2+] / [OH–]
Quando a base Pb(OH)2 é adicionada em água, forma-se o seguinte equilíbrio de dissolução:
Os íons liberados são o chumbo II (Pb+2) e o hidróxido (OH-). Na expressão do Kps, o cátion será elevado a um, por apresentar apenas uma unidade na fórmula, e o ânion será elevado ao quadrado, por apresentar duas unidades na fórmula.
Resposta: Letra c
Veja também: Como são formadas estalactites e estalagmites
Deslocamento de equilíbrio (Princípio de Le Chatelier)
De acordo com o princípio de Le Chatelier, existem três variáveis que podem perturbar um equilíbrio: temperatura, pressão e concentração. Sempre que um equilíbrio for perturbado, ele irá trabalhar de forma contrária à perturbação para criar uma nova situação de equilíbrio.
Concentração
Se a concentração de um participante diminui, o equilíbrio desloca-se para o lado dele.
Se a concentração de um participante aumenta, o equilíbrio desloca-se para o lado contrário.
Temperatura
Se a temperatura aumenta, o equilíbrio desloca-se no sentido endotérmico.
Se a temperatura diminui, o equilíbrio desloca-se no sentido exotérmico.
Obs.: desses fatores, a temperatura é o único fator que modifica a constante de equilíbrio (Kc).
Pressão
Se a pressão aumenta, o equilíbrio desloca-se no sentido que apresenta menor volume.
Se a pressão diminui, o equilíbrio desloca-se no sentido que apresenta maior volume.
Exemplo: Observe o seguinte equilíbrio químico:
Sobre esse equilíbrio químico, são formuladas as proposições abaixo:
I. A constante de equilíbrio pode ser designada por constante de ionização de ácido.
II. Quanto maior for a constante de equilíbrio, mais forte será o eletrólito.
III. O equilíbrio pode ser deslocado pela adição de uma base.
IV. A constante de equilíbrio independe da temperatura.
São afirmações corretas apenas:
a) I e II
b) I e III
c) I e IV
d) I, II e III
e) II, III e IV
I- Verdadeira, porque é um equilíbrio de um ácido.
II- Verdadeira, porque quanto maior a constante de equilíbrio, maior a força;
III- Verdadeira, pois a hidroxila da base tem afinidade com H+ do ácido, o que alteraria a concentração de H+ no equilíbrio.
IV- Falsa, porque a constante de equilíbrio depende da temperatura.
Casos particulares
Relação entre equilíbrio iônico da água e pH das soluções
A água é uma substância que sofre autoionização, ou seja, ela produz cátion hidrônio (H+) e ânion hidróxido (OH-), porém a quantidade de íons formada é muito pequena, formando o equilíbrio químico abaixo:
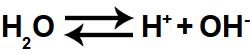
Equação representando a autoionização da água
Assim, sempre que tivermos uma solução aquosa, teremos o equilíbrio iônico da água. A constante de ionização da água, representada por Kw, é dada pela seguinte expressão:
Obs.: a água não aparece na expressão por ser uma constante na sua equação.
De acordo com dados experimentais, sabe-se que, em temperatura ambiente, a concentração dos íons hidrônio e hidróxido produzidos pela água é igual a 10-7 mol/L. A presença de uma substância (dissolvida) na água pode modificar a quantidade de íons hidrônio e hidróxido.
Como a grande maioria das substâncias utilizada no nosso dia a dia está dissolvida na água (soluções aquosas), a quantidade de cátions hidrônio e ânions hidróxido passou a ser uma referência para determinar a característica de um meio. Logo:
-
Meio ácido ou de pH menor que 7: trata-se de um equilíbrio químico em que a concentração de hidrônio é maior que a de hidróxido.
-
Meio básico ou de pH maior que 7: trata-se de um equilíbrio químico em que a concentração de hidrônio é menor que a de hidróxido.
-
Meio neutro ou de pH igual a 7: trata-se de um equilíbrio químico em que a concentração de hidrônio é igual à de hidróxido.
Veja também: Indicadores de pH
Equilíbrio químico e hidrólise salina
Quando um sal é dissolvido em água, além do equilíbrio de ionização da água, passamos a ter o equilíbrio de dissociação do sal (YW libera um cátion diferente de hidrônio e um ânion diferente de hidróxido). Logo, no meio, temos dois cátions e dois ânions.
A hidrólise ocorre quando pelo menos um dos íons provenientes da água interage com um dos íons do sal (cátion com ânion), formando ácido ou base. Porém, isso só ocorre se o eletrólito (ácido ou base) a ser formado for de natureza fraca.
Veja também: Força dos ácidos
Exemplo: Em uma determinada solução aquosa de NaCl, é verificado pH = 7. Isso se deve ao fato de:
a) ocorrer apenas hidrólise do cátion Na+.
b) ocorrer apenas hidrólise do ânion Cl–.
c) não ocorrer hidrólise, porque o NaOH e HCl são eletrólitos fortes.
d) ocorrer hidrólise do cátion e do ânion.
e) NaOH e HCl serem eletrólitos fracos
O NaCl, ao se dissolver na água, libera o cátion sódio (Na+), que é proveniente de eletrólito forte (por pertencer à família IA da tabela periódica), e o ânion cloreto (Cl-), que também é proveniente de um eletrólito forte (HCl, um dos três hidrácidos fortes).
Por isso, nesse exemplo, não ocorre hidrólise de nenhum dos íons provenientes do sal.
Resposta: Letra c
Equilíbrio químico e soluções-tampão
Sabe-se que um ácido, base ou sal, quando dissolvidos em água, sofrem dissociação, resultando em um equilíbrio iônico.
Quando um ácido fraco (que dissocia pouco), HX, é misturado com um sal (que apresenta o mesmo ânion do ácido), YX, ou quando uma base fraca (que também dissocia pouco), ZOH, é misturada com um sal (que apresenta o mesmo cátion da base), ZW, teremos a formação de uma solução-tampão.
Nesse tipo de solução, temos sempre a presença de dois equilíbrios químicos. Sua principal característica é de que esses equilíbrios não sofrem grandes perturbações nem alterações no seu pH quando recebem eletrólitos que ionizam muito, como ácidos ou bases fortes.
Um exemplo de solução-tampão é a mistura formada pelo ácido cianídrico (um ácido fraco, de fórmula HCN) e o sal cianeto de sódio (de fórmula NaCN).
Fórmulas utilizadas no equilíbrio químico
Além das fórmulas utilizadas para o cálculo das constantes do equilíbrio químico em termos de pressão (Kp) e concentração (Kc), temos as seguintes fórmulas:
-
Para constante de ionização de um ácido (Ki ou Ka).
-
Para constante de dissociação de uma base (Kd ou Kb).
Veja também: Classificação das bases
-
Para cálculo das constantes de ionização ou dissociação em soluções diluídas (Lei da diluição de Ostwald).
Sendo que, nessas fórmulas, M é a concentração em mol/L do eletrólito, e α é o grau de ionização ou de dissociação do eletrólito.
Exemplo 1: Uma solução 0,01 molar de um monoácido está 4,0% ionizada. A constante de ionização desse ácido é:
a) 1,6 x 10–3
b) 1,6 x 10–5
c) 3,32 x 10–5
d) 4,0 x 10–5
e) 3,0 x 10–6
Resposta: Letra b
Os dados fornecidos pelo exercício foram:
α = 4%
M = 0,01 mol/L
Para determinar o valor da constante de ionização, devemos utilizar a expressão para eletrólito fraco:
Ki = α2. M
Ki = (0,04)2.0,01
Ki = 0,0016.0,01
Ki = 0,00016 mol/L ou 1,6.10-5 mol/L
-
Para cálculo do pH.
Exemplo 2: A concentração dos íons H+ de uma solução é igual a 0,0001. O pH dessa solução é:
a) 1
b) 2
c) 4
d) 10
e) 14
Resposta: Letra c
O exercício indica que a concentração de cátion é 0,0001. Para determinar o pH, basta utilizarmos o valor na expressão:
[H+] = 10-pH
0,0001 = 10-pH
10-4 = 10-pH
-4 = -pH. (-1)
pH = 4
-
Para cálculo do pOH.
Exercício sobre equilíbrio químico no Enem
(Enem) Alguns profissionais burlam a fiscalização quando adicionam quantidades controladas de solução aquosa de hidróxido de sódio a tambores de leite de validade vencida. Assim que o teor de acidez, em termos de ácido lático, encontra-se na faixa permitida pela legislação, o leite adulterado passa a ser comercializado. A reação entre hidróxido de sódio e ácido lático pode ser representada pela equação química:
CH3CH(OH)COOH(aq) + NaOH(aq) →
CH3CH(OH)COONa(aq) + H2O(I)
Equilíbrio entre ácido lático e hidróxido de sódio
A consequência dessa adulteração é:
a) o aumento do pH do leite.
b) a diluição significativa do leite.
c) a precipitação do lactato de sódio.
d) a diminuição da concentração de sais.
e) o aumento da concentração dos íons H+.
O hidróxido de sódio é uma base forte, que dissocia muito e libera muitos ânions hidróxido. Com sua adição, ocorrerá um aumento do pH do leite.
Resposta: Letra a

.jpg)
.jpg)
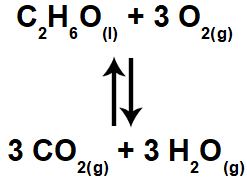
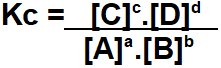
.jpg)