O deslocamento de um equilíbrio químico é a forma na qual um sistema reacional sai de uma situação de equilíbrio químico. Nesse deslocamento, a velocidade em que a reação direta (seta 1) ocorre é a mesma da reação inversa (seta 2).
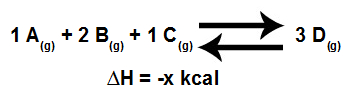
Modelo de uma equação em equilíbrio químico
Assim, durante o deslocamento de um equilíbrio químico, a reação inversa prevalece sobre a direta e tende à formação dos reagentes A, B, C ou a reação direta prevalece sobre a reação inversa e tende à formação do produto D.
Essas ocorrências foram reportadas pelo químico francês Henri Louis Le Chatelier. Ele descobriu que, quando um sistema em equilíbrio é perturbado, tende a trabalhar contra a perturbação gerada e, para isso, busca atingir uma nova situação de equilíbrio. Essa tendência do sistema é denominada de princípio de Le Chatelier.
Segundo os estudos realizados por Le Chatelier, os únicos fatores capazes de promover o deslocamento de um equilíbrio químico são:
-
Concentração do participante;
-
Temperatura;
Não pare agora... Tem mais depois da publicidade ;) -
Pressão.
Influência da concentração no deslocamento do equilíbrio
A mudança na concentração de um participante da reação é um fator que pode promover o deslocamento de um equilíbrio químico. De uma forma geral, segundo o princípio de Le Chatelier, com relação à modificação na concentração de um dos participantes, o equilíbrio comporta-se da seguinte maneira:
-
Aumento da concentração: o equilíbrio desloca-se no sentido contrário ao do participante;
-
Diminuição da concentração: o equilíbrio desloca-se no mesmo sentido do participante.
Exemplo de relação de equilíbrio:
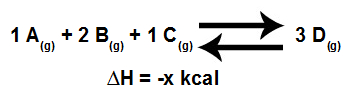
Modelo de uma equação em equilíbrio químico
Assim, se:
-
Aumentarmos a concentração dos reagentes A, B ou C: o equilíbrio será deslocado no sentido contrário a eles, ou seja, será deslocado para a direita (sentido da formação de D);
-
Aumentarmos a concentração do produto D: o equilíbrio será deslocado no sentido contrário ao dos reagentes, ou seja, será deslocado para a esquerda (sentido da formação dos reagentes A, B e C);
-
Diminuirmos a concentração dos reagentes A, B ou C: o equilíbrio será deslocado no mesmo sentido deles, ou seja, será deslocado para a esquerda (sentido da formação dos reagentes);
-
Diminuirmos a concentração do produto D: o equilíbrio será deslocado no mesmo sentido dele, ou seja, será deslocado para a direita (sentido da formação do produto).
Não pare agora... Tem mais depois da publicidade ;)
Obs.: A mudança na concentração de participantes sólidos não provoca o deslocamento no equilíbrio.
Influência da temperatura no deslocamento do equilíbrio
A modificação da temperatura, durante uma reação química, é um fator que pode promover o deslocamento de um equilíbrio químico. Em relação a essa mudança de temperatura, de uma forma geral, segundo o princípio de Le Chatelier, o equilíbrio comporta-se da seguinte forma:
-
No aumento da temperatura: o equilíbrio desloca-se no sentido da reação endotérmica;
-
Na diminuição da temperatura: o equilíbrio desloca-se no sentido da reação exotérmica.
Para realizar a análise da influência da temperatura em um equilíbrio, é fundamental conhecer a natureza das reações direta e inversa que é determinada pela variação da entalpia da reação. Assim, se:
-
∆H positivo: reação direta endotérmica e reação inversa exotérmica;
-
∆H negativo: reação direta exotérmica e reação inversa endotérmica.
Por exemplo, com relação ao equilíbrio a seguir:
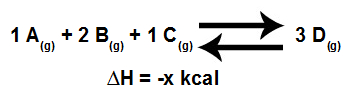
Modelo de uma equação em equilíbrio químico
Nesse caso, por ter ∆H negativo, a reação direta é exotérmica e a reação inversa é endotérmica. Assim, se:
-
Aumentarmos a temperatura do sistema, o equilíbrio será deslocado no sentido inverso (da reação endotérmica), ou seja, será deslocado para a esquerda (sentido da formação dos reagentes);
Não pare agora... Tem mais depois da publicidade ;) -
Diminuirmos a temperatura do sistema, o equilíbrio será deslocado no sentido direto (da reação exotérmica), ou seja, será deslocado para a direita (sentido da formação do produto D).
Influência da pressão no deslocamento do equilíbrio
Durante uma reação química, a mudança da pressão no ambiente é um fator que pode promover o deslocamento de um equilíbrio químico. De uma forma geral, segundo o princípio de Le Chatelier, o equilíbrio comporta-se da seguinte maneira com o(a):
-
Aumento da pressão: o equilíbrio desloca-se no sentido de menor volume;
-
Diminuição da pressão: o equilíbrio desloca-se no sentido de maior volume.
Para realizar a análise da influência da pressão em um equilíbrio, é fundamental conhecer o volume estabelecido nos reagentes e nos produtos, o qual pode ser determinado pelos coeficientes que tornam a equação balanceada, como no exemplo a seguir:
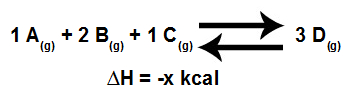
Modelo de uma equação em equilíbrio químico
Dessa forma, os reagentes apresentam um volume de 4L, que é obtido pela soma dos coeficientes 1, 2 e 2, e o produto, que é único, apresenta um volume de 3L (dado pelo coeficiente 3).
Assim, em relação ao equilíbrio acima, se:
-
Aumentarmos a pressão do sistema, o equilíbrio será deslocado no sentido direto (do menor volume, 3L), ou seja, será deslocado para a direita (sentido da formação do produto D).
-
Diminuirmos a pressão do sistema, o equilíbrio será deslocado no sentido inverso (do maior volume, 4 L), ou seja, será deslocado para a esquerda (sentido da formação dos reagentes).
Obs.: O aumento ou diminuição da pressão em um sistema em equilíbrio pode promover o deslocamento apenas em situações em que o volume dos reagentes é diferente do volume dos produtos.
Por Me. Diogo Lopes Dias


.jpg)