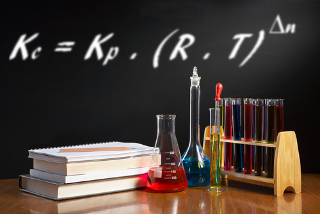Muitos exercícios sobre o conteúdo de Equilíbrio químico incluem cálculos que envolvem a relação entre as constantes de equilíbrio Kc (em termos de concentração) e Kp (em termos de pressões dos gases). Se houver quaisquer dúvidas sobre o que essas constantes representam e como suas expressões são escritas para cada reação em equilíbrio, leia o texto Constantes de Equilíbrio Kc e Kp.
A relação entre essas constantes é estabelecida pelas seguintes fórmulas:
Kc = Kp . (R . T)∆n e Kp = Kc . (R . T)-∆n
Mas como se chegou a essas fórmulas?
Bem, vamos considerar a reação genérica a seguir em que as letras minúsculas são os coeficientes da equação e as letras maiúsculas são as substâncias (reagentes e produtos), sendo todas gasosas:
a A + b B ↔ c C + d D
Para tal reação, as expressões das constantes de equilíbrio Kc e Kp são, respectivamente, dadas por:
Kc = c . d Kp = (pC)c . (pD)d
a . b (pA )a. (pB)b
Vamos então utilizar a equação de Clapeyron ou equação de estado dos gases:
p . V = n . R . T
p = n . R . T
V
A concentração em quantidade de matéria (em mol/L) das substâncias pode ser calculada por n/V. Então, podemos fazer a seguinte substituição na fórmula acima:
p = [substância] . R . T
Usando essa fórmula para cada um dos reagentes e produtos da reação em questão, temos:
pA = . R . T pB = . R . T pC = . R . T pD = . R . T
= __pA_ = __pB_ = __pC_ = __pD_
R . T R . T R . T R . T
Assim, podemos substituir essas concentrações na expressão de Kc mostrada mais acima:
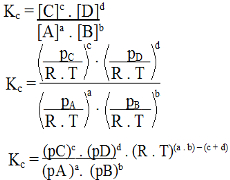
Mas, como vimos, (pC)c . (pD)d é exatamente igual a Kp. Por isso, temos:
(pA )a. (pB)b
Kc = Kp . (R . T)(a + b) – (c +d)
Veja que (a + b) – (c +d) é o mesmo que: “soma dos coeficientes dos reagentes – soma dos coeficientes dos produtos”. Desse modo, podemos simplificar ainda mais assim:
(a + b) – (c +d) = ∆n
Portanto, chegamos às fórmulas que relacionam Kc e Kp:
Kc = Kp . (R . T)∆n ou Kp = Kc . (R . T)-∆n
Vejamos algumas reações em equilíbrio químico e como determinar essas expressões para elas.
Observação importante: ∆n envolve apenas os coeficientes das substâncias que estão no estado gasoso.
N2(g) + 3 H2(g) ↔ 2 NH3(g)
Kc = Kp . (R . T)(4 – 2)
Kc = Kp . (R . T)2
3 O3(g) ↔ 2 O2(g)
Kc = Kp . (R . T)(3 - 2)
Kc = Kp . (R . T)1
Kc = Kp . R . T
H2(g) + I2(g) ↔ 2 HI(g)
Kc = Kp . (R . T)(2 – 2)
Kc = Kp . (R . T)0
Kc = Kp
CO(g) + NO2(g) ↔ CO2(g)+ NO(g)
Kc = Kp . (R . T)(2 – 2)
Kc = Kp . (R . T)0
Kc = Kp
2 SO3(g) ↔ 2 SO2(g) + O2(g)
Kc = Kp . (R . T)(2 – 3)
Kc = Kp . (R . T)-1
2 NO2(g) ↔ N2O4(g)
Kc = Kp . (R . T)(2 – 1)
Kc = Kp . (R . T)1
Kc = Kp . R . T
HCl(aq) + AgNO3(aq) ↔ AgCl(s) + HNO3(aq)
Kc = não definido – não possui gases.
C(s) + O2(g) ↔ CO2(g)
Kc = Kp . (R . T)(1- 1 )
Kc = Kp . (R . T)0
Kc = Kp
Veja que, nesse caso, o coeficiente de C(s) não participou.
Por Jennifer Fogaça
Graduada em Química