Em uma solução saturada de cloreto de prata (AgCl), por exemplo, a equação da dissociação iônica desse sal em meio aquoso é dada abaixo:
AgCl(s) ↔ Ag+(aq) + Cl-(aq)
Se adicionarmos a essa solução saturada uma solução aquosa de ácido clorídrico (HCl), poderemos observar a formação de um precipitado de cloreto de prata, pois, conforme dito, a solução estará saturada, portanto, já possuirá a quantidade máxima de AgCl que pode ser dissolvida nesse volume de água e em temperatura ambiente.
O mesmo podemos falar dos íons Ag+(aq) e Cl-(aq); eles possuíam as maiores concentrações em mol/L possíveis.
A dissociação do HCl em meio aquoso é dada pela equação a seguir:
HCl(aq) ↔ H+(aq) + Cl-(aq)
Observe que o íon cloreto (Cl-(aq)) é o íon comum ao equilíbrio. Desse modo, quando se adiciona o HCl, aumenta-se a concentração de Cl-(aq). Segundo o princípio de Le Chatelier:

Isso significa que com a adição de íons cloreto, eles ficarão em excesso no sistema, o que favorecerá o deslocamento do equilíbrio para o sentido de consumi-los, ou seja, no sentido da reação para a esquerda, da reação inversa, ocorrendo a formação de precipitado AgCl(s).
É importante ressaltar que o efeito do íon comum só afeta o deslocamento de uma reação em equilíbrio, mas não altera a constante de equilíbrio (Kc), desde que a temperatura seja mantida constante, pois ela só é afetada por uma mudança na temperatura.
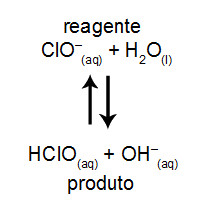
Além disso, o pH da solução também pode ser alterado: como o equilíbrio é deslocado para a esquerda, diminui-se o grau de ionização do ácido ou da base.
Por exemplo, se adicionarmos acetato de sódio (NaCH3COO) numa solução aquosa de ácido acético diluído (CH3COOH), o deslocamento do equilíbrio será para a esquerda, pois o íon comum, no caso, é o íon acetato (CH3COO-(aq)). Esses íons terão que ser consumidos, formando-se ácido não ionizado.
Veja como isso ocorre analisando separadamente a dissociação do acetato de sódio e do ácido acético:
- NaCH3COO(s) ↔ Na+(aq) + CH3COO-(aq)
- CH3COOH(aq) ↔ H+(aq) + CH3COO-(aq)
Veja que como o íon acetato é o íon comum, o deslocamento do equilíbrio faz com que eles sejam consumidos e que o grau de ionização do ácido acético diminua. Portanto, o efeito do íon comum provoca a diminuição da concentração de íons H+(aq), aumentando o valor do pH.
O efeito do íon comum explica importantes processos químicos e físicos
Por Jennifer Fogaça
Graduada em Química