PUBLICIDADE
A hidrólise salina entre ácidos e bases fortes ocorre quando o cátion de um sal não interage com o ânion da água, e o ânion do sal não interage com o cátion da água. A hidrólise entre cátions e ânions de um sal e da água ocorre apenas quando o produto formado é um ácido fraco, uma base fraca ou ambos. Compreenda a hidrólise salina entre ácidos e bases fortes passo a passo:
a) Passo 1: Ionização da água
A água é uma substância que apresenta a capacidade de sofrer autoionização, ou seja, ela produz cátion hidrônio (H+) e ânion hidróxido (OH-) a partir de sua estrutura.
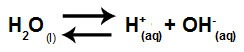
Equação que representa a autoionização da água
b) Passo 2: Dissociação do sal
Quando um sal é adicionado à água, ele passa pelo processo da dissociação. Como o sal é um composto iônico, em água, seus cátions e ânions são liberados no meio, como na equação representada a seguir:
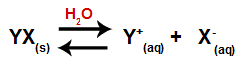
Equação que representa a dissociação de um sal qualquer
c) Passo 3: Hidrólise salina de ácidos e bases fortes
-
Para ácido forte: quando o ânion do sal combinado com o H+ da água formar HCl, HBr, HI ou outro ácido em que a subtração do número de oxigênios pelo número de hidrogênios for igual ou maior que 2, teremos um ácido forte. Logo, a combinação entre os íons mencionados não ocorre.
-
Para base forte: quando o cátion do sal que pertence às famílias IA (metais alcalinos) ou IIA (metais alcalinoterrosos, com exceção do magnésio) for combinado com o OH- da água, ele formará uma base forte. Logo, a combinação entre os íons mencionados não ocorre.
Quando os íons do sal não interagem com os íons da água, temos a seguinte equação:
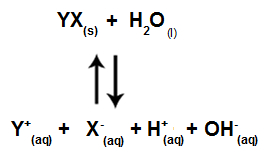
Equação que apresenta todos os íons presentes na solução
Em resumo, como não ocorre a interação dos íons do sal com os íons da água, os íons do sal não promovem nenhuma alteração na solução final. Sendo assim, podemos escrever a equação de uma hidrólise salina entre ácidos e bases fortes apenas com a equação de ionização da água.
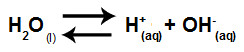
Equação que representa a hidrólise de ácidos e bases fortes
d) Exemplo de hidrólise salina entre ácidos e bases fortes
Quando adicionamos o sal clorato de potássio à água (KClO3), o sal dissocia-se e libera o cátion potássio (K+) e o ânion clorato (ClO3-) no meio.
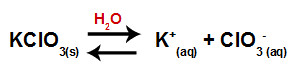
Equação de dissociação do clorato de potássio
É importante lembrar que a água sofre autoionização e fornece ao meio cátion hidrônio (H+) e ânion hidróxido (OH-). Devemos agora avaliar a interação entre os íons do sal e da água.
-
Quando o H+ interage com o ClO3-, ele forma o ácido perclórico (HclO3). Como a subtração do número de oxigênios pelo número de hidrogênios ionizáveis do ácido perclórico é 2, ele é forte. Logo, a interação entre os íons não ocorre.
-
Quando o cátion K+ interage com o ânion OH-, temos a formação de uma base forte, pois o potássio é um metal alcalino. Logo, a interação entre os íons não ocorre.
A equação que representa a hidrólise salina entre ácidos e bases fortes a partir da dissolução do clorato de potássio em água é:
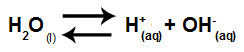
Equação química da hidrólise do clorato de potássio
Por Me. Diogo Lopes Dias






