Pressão parcial, lei das pressões parciais, ou lei de Dalton foi proposta pelo cientista John Dalton, que realizou vários estudos meteorológicos e relacionados à composição do ar atmosférico. De acordo com ele,
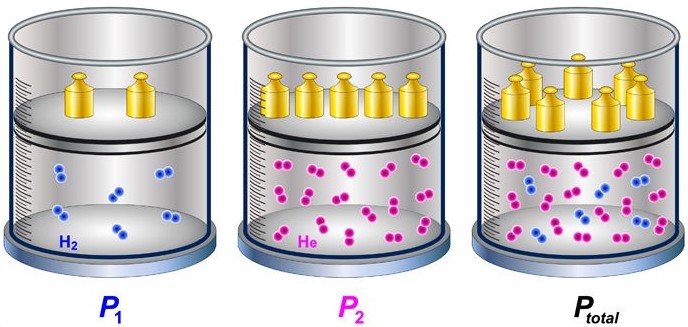
“Pressão parcial é a força que as moléculas de um gás exerce nas paredes de um recipiente, a qual é exatamente a mesma que ele exerceria se estivesse em uma mistura gasosa.”
Baseado nessa conclusão, Dalton afirmava que a pressão exercida por uma mistura gasosa (Pressão total, Pt) nas paredes de um recipiente é igual à soma das pressões parciais individuais de cada um dos gases componentes dessa mistura.
Pt = PA + PB + PC
Na qual,
PA = pressão parcial do gás A
PB = pressão parcial do gás B
PC = pressão parcial do gás C
Por exemplo, se temos uma mistura formada pelos gases hidrogênio (H2), oxigênio (O2) e gás carbônico (CO2) dentro de um recipiente, a pressão dessa mistura é a resultante da soma das pressões de cada um desses gases, logo:
Pt = PH2 + PO2 + PCO2
1- Relação da pressão parcial com a pressão total
De acordo com John Dalton, a relação entre a pressão parcial de um certo gás (PA) com a pressão total da mistura gasosa é sempre igual à fração molar (XA) do gás, o que resulta na seguinte fórmula:
PA = XA
Pt
Vale ressaltar que a fração molar de um gás é dada pela relação entre o número de mol (nA) desse gás pelo número de mol (nt) da mistura gasosa (resultante da soma do número de mol de todos os gases que formam a mistura).
XA = nA
nt
Assim, se substituirmos a fórmula da fração molar do gás na expressão da relação entre as pressões parciais, temos:
PA = nA
Pt nt
2- Pressão total de uma mistura gasosa
A pressão total de uma mistura gasosa pode ser encontrada não apenas somando as pressões parciais dos gases que a compõe. Pode ser calculada através da equação de Clapeyron:
Pt.Vt = nt.R.T
Essa fórmula pode ser utilizada para o cálculo da pressão total, desde que seja utilizado o volume do recipiente (ou o volume total dos gases) e o número de mol total (nt), sendo:
R = constante geral dos gases
T = temperatura da mistura em Kelvin
Obs.: Caso a temperatura esteja em graus Celsius, transforme-a em Kelvin; para isso basta somar o valor fornecido com 273.
3- Exemplo de aplicação da pressão parcial de um gás
Exemplo: (FEI SP) Num recipiente de 44,8L, mantido a 273K, foram misturados 4 mol de gás hidrogênio e 6 mol de gás oxigênio em CNTP. As pressões parciais de H2 e O2, em atmosferas, são, respectivamente:
a) 1,0 e 2,0
b) 3,0 e 4,5
c) 0,8 e 1,2
d) 1,0 e 1,5
e) 2,0 e 3,0
Dados fornecidos pelo exercício:
Temperatura = 273 K
Volume do sistema = 44,8 L
Número de mol do gás hidrogênio = 4 mol
Número de mol do gás oxigênio = 6 mol
PH2= ?
PO2= ?
1o Passo: Calcular o número de mol total
nt = nH2 + nO2
nt = 4 + 6
nt = 10 mol
2o Passo: Calcular a pressão total (Pt) do sistema utilizando a equação de Clapeyron
Pt.Vt = nt.R.T
Pt.44,8 = 10.0,082.273
Pt.44,8 = 223,86
Pt = 223,86
44,8
Pt = 4,996875 atm, logo Pt é aproximadamente 5 atm
3o Passo: Calcular a pressão parcial do gás hidrogênio
PH2 = nH2
Pt nt
PH2 = 4
5 10
PH2.10 = 4.5
PH2.10 = 20
PH2 = 20
10
PH2 = 2 atm
4o Passo: Calcular a pressão parcial do gás oxigênio
Como temos apenas dois gases na mistura e conhecemos a pressão de um deles e a pressão total, para calcular a pressão parcial do gás oxigênio basta utilizarmos a expressão da pressão total da mistura:
Pt = PH2 + PO2
5 = 2 + PO2
PO2 = 5 – 2
PO2 = 3 atm
Por Me. Diogo Lopes Dias