Quando falamos a palavra “equilíbrio” logo nos vem à mente um objeto que fica parado indefinidamente. Porém, esse é apenas um tipo de equilíbrio, denominado “equilíbrio estático”.
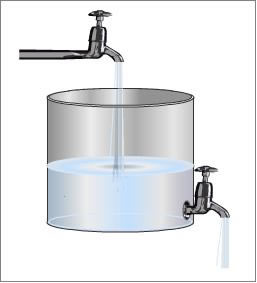
Existe também o “equilíbrio dinâmico”. Nele, como o próprio nome diz, não há um só momento em que o objeto ou o fenômeno em questão fique parado. Por exemplo, para você entender, veja a ilustração abaixo e note que a quantidade de água que cai dentro do recipiente é igual à quantidade que escoa dele, mantendo o nível de água constante. Nesse caso, dizemos que há um equilíbrio dinâmico, um equilíbrio em movimento.
É esse tipo de equilíbrio que ocorre nas reações reversíveis, ou seja, naquelas reações que ocorrem nos dois sentidos. Ao mesmo tempo em que as moléculas dos reagentes se transformam nos produtos, as moléculas dos produtos reagem entre si para formar os reagentes. A reversibilidade de uma reação é representada pelas setas nos dois sentidos:
.jpg)
No momento em que a taxa de desenvolvimento da reação direta (de formação dos produtos) é igual à taxa de desenvolvimento da reação inversa (de formação dos reagentes), sob temperatura constante, significa que a reação chegou ao seu equilíbrio químico. E no caso de reações com a presença apenas de moléculas nos reagentes e nos produtos, temos um equilíbrio molecular.
A seguir temos o exemplo da reação que ocorre entre o gás hidrogênio (H2) e o gás iodo (I2), para a formação do gás iodeto de hidrogênio (HI):
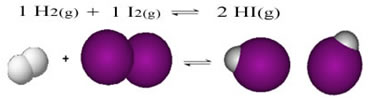
No início da reação, a taxa de desenvolvimento da reação direta era maior, afinal de contas a concentração dos reagentes era máxima e a dos produtos era zero. Assim, a taxa de desenvolvimento da reação inversa era zero também.
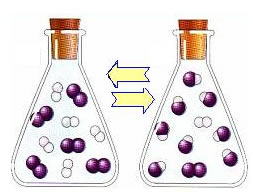
Porém, com o passar do tempo, os gases hidrogênio e iodo reagem, gerando o produto. Dessa forma, a concentração dos reagentes começa a diminuir e a sua taxa de desenvolvimento também diminui.
Com o aumento da concentração dos produtos e a diminuição da concentração dos reagentes, a taxa de desenvolvimento da reação inversa começa a aumentar. Se a temperatura for mantida constante chegará um momento em que as duas taxas de desenvolvimento irão se manter as mesmas, mostrando, assim, que a reação alcançou o equilíbrio químico molecular.
Por Jennifer Fogaça
Graduada em Química
