A constante de equilíbrio (K) é utilizada para caracterizar as quantidades dos participantes em um equilíbrio químico. Para diferenciar as quantidades que estão sendo tratadas, é comum a utilização de índices como Kc, para expressar que as quantidades estão em concentração molar, e Kp, para expressar que as quantidades estão em pressões parciais.
A constante de equilíbrio pode ser calculada por meio do quociente entre as quantidades dos produtos e reagentes no equilíbrio químico. Os coeficientes estequiométricos, na expressão da constante de equilíbrio, tornam-se expoentes da expressão. Líquidos puros e sólidos não entram na expressão do K; além disso, apenas gases podem ser usados para o Kp. Apenas a temepratura é capaz de alterar o valor de K.
Leia também: O que é o equilíbrio químico?
Tópicos deste artigo
- 1 - Resumo sobre constante de equilíbrio
- 2 - O que é constante de equilíbrio?
- 3 - O que é Kc e Kp?
- 4 - Fórmulas da constante de equilíbrio
- 5 - Como calcular a constante de equilíbrio?
- 6 - Relação da constante de equilíbrio e as grandezas termodinâmicas
- 7 - Constante de equilíbrio x quociente da reação
- 8 - Exercícios resolvidos sobre constante de equilíbrio
Resumo sobre constante de equilíbrio
- A constante de equilíbrio (K) é uma grandeza que serve para caracterizar um equilíbrio químico em dada temperatura.
- Ajuda demonstrando a relação entre as quantidades dos participantes do processo químico que estão em equilíbrio.
- É comum utilizar Kc para expressar a constante de equilíbrio que usa concentração molar e Kp para expressar a constante de equilíbrio que usa pressão parcial.
- A constante de equilíbrio é calculada pelo quociente entre as quantidades dos produtos sobre os reagentes, em que cada participante tem seu coeficiente estequiométrico elevado.
- Sólidos e líquidos puros não entram na constante de equilíbrio, além disso, apenas gases participam do Kp.
- Apenas a temperatura é capaz de alterar o valor da constante de equilíbrio.
O que é constante de equilíbrio?
A constante de equilíbrio é uma grandeza utilizada para caracterizar um equilíbrio químico em dada temperatura, demonstrando a relação das quantidades dos participantes da reação em equilíbrio, ou seja, demonstrando a composição química do equilíbrio químico descrito. É comumente representado pela letra K.
Vale lembrar que um equilíbrio químico é atingido quando as velocidades das reações que ocorrem no sentido direto e inverso se igualam, mantendo as quantidades dos participantes, como a concentração deles, constantes ao longo do tempo.
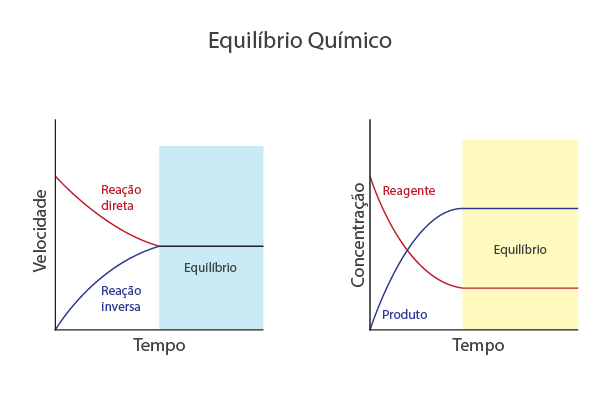
O que é Kc e Kp?
Kc e Kp são formas didáticas de se referir à constante de equilíbrio. Isso porque a constante de equilíbrio descreve as quantidades dos participantes no equilíbrio, ou seja, demonstram se o equilíbrio foi atingido com maior quantidade de produto, ou de reagente, dando importantes avaliações sobre em que ponto o equilíbrio foi estabelecido. Essas quantidades podem ser diversas, como a concentração molar e a pressão parcial.
Por isso, para diferenciar didaticamente que tipo de quantidade está sendo analisada, os autores costumam utilizar índices subscritos, embora não seja obrigatório:
- Kc: quando a constante de equilíbrio está em termos de concentrações molares no equilíbrio.
- Kp: quando a constante de equilíbrio está em termos de pressão parcial dos participantes no equilíbrio.
Fórmulas da constante de equilíbrio
A constante de equilíbrio (K) pode ser descrita, genericamente, pelo seguinte produtório:
- x → quantidade do participante da reação.
- n → coeficiente estequiométrico da reação química balanceanda, podendo ser positivo (no caso dos produtos) ou negativo (no caso dos reagentes).
Assim sendo, para a reação química genérica a seguir:
A2 + 3 B2 ⇌ 2 AB3
A expressão para o Kc é igual a:
- [ ] → concentrações dos participantes no equilíbrio, em mol.L−1.
Analogamente, para o Kp, temos:
- P → pressões parciais dos participantes no equilíbrio.
Há, entretanto, algumas limitações para os participantes a serem inseridos tanto no Kc quanto no Kp.
No caso do Kc, sólidos ou líquidos puros não interferem no equilíbrio químico, e, para demonstrar neutralidade, utiliza-se o valor igual a 1 (fator neutro do produto). Assim, no equilíbrio, apenas gases e solutos em solução diluída são levados em conta:
AgCl (s) ⇌ Ag+ (aq) + Cl− (aq)
A expressão para o Kc é dada por:
Considerando-se que AgCl está na forma sólida, enquanto os íons Ag+ e Cl− são solutos que estão diluídos em solução.
Da mesma forma, para o Kp só podem ser levadas em consideração substâncias que, no equilíbrio, estão em fase gasosa. Assim, no equilíbrio:
CaCO3 (s) ⇌ CaO (s) + CO2 (g)
A expressão para o Kp é dada por:
Pois apenas o CO2 está na forma gasosa.
Um outro ponto importante é que as constantes Kp e Kc podem ser relacionadas pela seguinte expressão:
- R → constante dos gases ideais.
- T → temperatura (em Kelvin).
- Δn → diferença entre os coeficientes estequiométricos dos produtos e reagentes participantes do equilíbrio.
Por exemplo, no equilíbrio hipotético apresentado anteriormente (A2 + 3 B2 ⇌ 2 AB3), o valor de Δn é dado pela seguinte expressão:
Δn = 2 – (3 + 1) → Δn = −2
Por exemplo, no equilíbrio descrito anteriormente:
CaCO3 (s) ⇌ CaO (s) + CO2 (g)
O valor de Δn será igual a 1, pois tanto CaCO3 quanto CaO não participam do equilíbrio.
Como calcular a constante de equilíbrio?
A constante de equilíbrio é calculada unica e exclusivamente pelo cálculo da expressão. A questão é que, em alguns problemas propostos, as quantidades no equilíbrio estão ocultas. Por exemplo, vamos supor, tomando como base o equilíbrio hipotético anterior:
A2 + 3 B2 ⇌ 2 AB3
Imagina-se que foram colocados para reagir, em 1,0 L de água, 0,10 mol de A2 e 0,10 mol de B2. Ao fim da reação, percebeu-se a formação de 0,02 mol de AB3. Como calcular a constante Kc?
A melhor metodologia passa por avaliar três pontos da reação: início, reação e equilíbrio. No início da reação, não há quantidades de AB3, pois essa substância é um produto. Contudo, se 0,02 mols foram produzidos, isso quer dizer que houve um consumo, proporcional, de A2 e B2. Faz-se então uma tabela resumida dessas informações.
|
Etapa |
A2 |
3 B2 |
2 AB3 |
|
Início |
0,10 |
0,10 |
0 |
|
Reação |
−0,01 |
−0,03 |
+0,02 mols |
|
Equilíbrio |
0,09 mol |
0,07 mol |
0,02 mol |
Repare que, caso sejam formados 0,02 mol de AB3 ao longo da reação, os reagentes A2 e B2 devem ser consumidos, porém respeitando a proporção estequiométrica. Assim, como o índice estequiométrico de AB3 é o dobro de A2 (2:1), então o consumo de A2 é a metade da quantidade de mol de AB3 (consumo de 0,01 mol contra uma produção de 0,02 mol) produzida. Da mesma forma, como o coeficiente estequiométrico de B2 é o triplo de A2 (3:1), então o consumo de B2 é o triplo de A3 (consumo de 0,03 mol contra 0,01 mol).
Por isso, as quantidades, em mol, dos participantes no equilíbrio são iguais a 0,09 mol (A2), 0,07 mol (B2) e 0,02 mol (AB3). Para o cálculo do Kc, como são utilizados os valores de concentração molar (mol.L−1), deve-se dividir o número de mols pelo volume da situação (no caso, 1,0 L). Assim, a expressão do Kc fica:
Relação da constante de equilíbrio e as grandezas termodinâmicas
Das alterações que podem ser feitas em sistema, apenas a temperatura é capaz de alterar o valor da constante de equilíbrio, enquanto a pressão não. Isso é uma consequência direta de compreensões matemáticas das leis da termodinâmica, cujas discussões não cabem aqui. Contudo, é possível dizer que a variação de K é diretamente proporcional ao produto da variação de entalpia com a variação da temperatura:
Assim sendo, para uma reação exotérmica (ΔH < 0), a queda da temperatura (ΔT < 0) faz com que ΔK tenha um incremento (variação positiva). Do contrário, um acréscimo da temperatura (ΔT > 0) faz com que ΔK tenha um decréscimo (variação negativa). Para uma reação endotérmica (ΔH > 0), a interpretação é diametralmente oposta.
A reação Ag2CO3 (s) ⇌ Ag2O (s) + CO2 (g) tem um ΔH = + 80kJ.mol−1. A variação de K com a temperatura é dada a seguir:
|
Temperatura (em Kelvin) |
Constante K |
|
350 K |
3,98 x 10−4 |
|
400 K |
1,41 x 10−2 |
|
450 K |
1,86 x 10−1 |
|
500 K |
1,48 |
Repare que, como o processo é endotérmico, (ΔH > 0), um aumento da temperatura (ΔT > 0) fez com que a constante K aumentasse (ΔK > 0).
Constante de equilíbrio x quociente da reação
Um conceito importante é o do quociente da reação (Q), cuja expressão matemática é idêntica à constante de equilíbrio (K). A diferença, entretanto, é que o quociente de reação é relativo a qualquer estágio da reação (e não só do equilíbrio). Assim, por exemplo, alterações nas quantidades, como concentração ou pressão, alteram o valor de Q, mas não alteram o valor de K. Dito isso, valem as interpretações:
- Q > K: nesse ponto, a reação apresenta menores quantidades de reagentes e maiores quantidades de produtos que a estabelecida em equilíbrio.
- Q < K: nesse ponto, a reação apresenta maiores quantidades de reagentes e menores quantidades de produtos que a estabelecida em equilíbrio.
- Q = K: a reação se encontra em equilíbrio químico.
Exercícios resolvidos sobre constante de equilíbrio
Questão 1
(Uece) Ao estudar uma reação química que se encontra em equilíbrio químico, dependendo das condições, deve-se considerar a constante de equilíbrio em função das concentrações (Kc) e a constante de equilíbrio em função das pressões parciais (Kp).
Assinale a opção que corresponde à reação química em que Kc = Kp.
A) 2 NO (g) + Cℓ2 (g) ⇄ 2 NOCℓ (g)
B) PCℓ5 (g) ⇄ PCℓ3 (g) + Cℓ2 (g)
C) N2 (g) + O2 (g) ⇄ 2 NO (g)
D) CaO (s) + CO2 (g) ⇄ CaCO3 (s)
Resolução:
Alternativa C
O Kp é calculado mediante pressões parciais e, assim sendo, só pode ser expresso para participantes gasosos. A relação entre Kc e Kp é dada pela expressão:
Para que haja igualdade entre Kp e Kc, o fator (RT)Δn tem que ser igual a 1. O único jeito é que Δn = 0, pois todo número elevado a 0 é igual a 1 e, consequentemente, Kp = Kc.
Para que Δn = 0, o somatório dos coeficientes estequiométricos de produtos e reagentes deve ser igual, de modo que a diferença seja igual, então, a 0. A única equação em que isso ocorre é a da letra C, pois o somatório dos coeficientes dos reagentes é igual a 2 (1 do N2 e mais 1 do O2), enquanto o somatório dos coeficientes dos produtos é também igual a 2 (2 do NO).
Questão 2
(Uerj) Considere a reação de equilíbrio químico representada abaixo, que ocorre na atmosfera e envolve dois óxidos de nitrogênio:
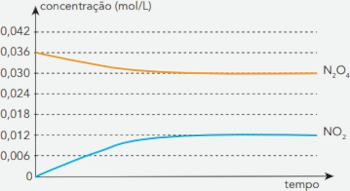
A partir de um experimento, foram registradas as variações das concentrações desses óxidos em função do tempo. Observe o gráfico:
Com base nos dados obtidos, o valor da constante de equilíbrio em função das concentrações é igual a:
A) 3,2 × 10−3
B) 4,8 × 10−3
C) 3,3 × 10−1
D) 4,0 × 10−1
Resolução:
Alternativa B
Em primeiro lugar, deve-se entender qual é o processo químico descrito. Ao se ver o gráfico, percebe-se que o N2O4 está sendo consumido, enquanto o NO2 está sendo produzido (quantidade inicial igual a 0). Assim, a equação química para o processo reacional é:
N2O4 ⇌ 2 NO2
O Kc é calculado com as concentrações no equilíbrio, atingido quando as concentrações permanecem constantes ao longo do tempo, ou seja, 0,030 mol/L para o N2O4 e 0,012 mol/L para o NO2.
A expressão do Kc é dada por:
Fontes
ATKINS, P.; DE PAULA, J.; KEELER, J. Physical Chemistry. 11. ed. Oxford: Oxford University Press, 2018.
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
CASTELLAN, G. Fundamentos de Físico-Química. 1. ed. Barueri: LTC Editora, 1986.


