Uma reação reversível ocorre quando é possível transformar novamente os produtos nos reagentes. Esse tipo de reação entra em equilíbrio químico quando a taxa de desenvolvimento da reação direta, ou seja, a reação com consumo de reagentes e formação de produtos ocorre com a mesma velocidade que a da reação inversa – formação de reagentes e consumo de produtos.
Esses tipos de reações em equilíbrio são muito vistas no cotidiano. Um exemplo é o que ocorre nas cavernas, na formação das chamadas estalactites e estalagmites.
A água subterrânea está submetida a altas pressões, por isso ela contém grandes quantidades de gás carbônico (CO2(g)) dissolvido nela. Ao passar por solos que contêm calcário (CaCO3(s)), ocorre a dissolução deste carbonato e as cavernas são formadas, segundo a reação abaixo:
CaCO3(s) + CO2(g) + H2O(l) → Ca2+(aq) + 2 HCO-3(aq)
No entanto, os íons carbonato e cálcio podem reagir, voltando a se precipitar como carbonato de cálcio. Isso é demonstrado pela reação:
Ca2+(aq) + 2 HCO-3(aq)→ CaCO3(s) + CO2(g) + H2O(l)
Conforme você deve ter percebido, uma reação é exatamente o inverso da outra: os reagentes se transformam nos produtos e os produtos nos reagentes. Assim, nós podemos representar essa reação em equilíbrio da seguinte maneira:
CaCO3(s) + CO2(aq) + H2O(l) ![]() Ca2+(aq) + 2 HCO-3(aq)
Ca2+(aq) + 2 HCO-3(aq)
A disposição lenta e contínua de carbonato das gotas mineralizadas do teto das cavernas escorrem, sua água evapora e há liberação de CO2. De modo que o equilíbrio químico é deslocado no sentido inverso (de formação dos reagentes), por isso o CaCO3(s) é formado,ou seja, formam-se as estalactites no teto das cavernas. Ao cair, a gota ainda possui dissolvido o carbonato, que é depositado no solo da caverna, formando as estalagmites.
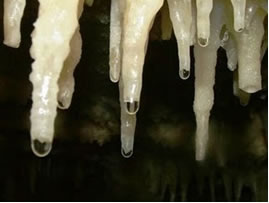
Água com calcário pingando para a formação das estalactites e estalagmites
Por Jennifer Fogaça
Graduada em Química
