As reações reversíveis geralmente iniciam com uma quantidade determinada de reagentes. Como a reação direta se inicia, com o passar do tempo, esses reagentes vão sendo consumidos para a formação dos produtos, consequentemente a concentração dos reagentes diminui enquanto a concentração dos produtos aumenta. Então, a reação inversa também começa, produzindo também os reagentes, até que a taxa de desenvolvimento (velocidade) das reações direta e inversa permanece a mesma, atingindo o chamado equilíbrio químico.
No equilíbrio, há a constante de equilíbrio Kc, que é expressa basicamente por:
| Kc = coeficiente na equação química balanceada coeficiente na equação química balanceada |
Ou seja, considerando a seguinte reação genérica em equilíbrio:
a A + b B ↔ c C + d D
Tendo que as letras minúsculas são os coeficientes, e as letras maiúsculas são as substâncias, a constante de equilíbrio dessa reação será:
Kc = c . d
a . b
Mais detalhes sobre isso podem ser vistos no texto Constantes de equilíbrio Kc e Kp. Esse texto mostra-nos também algo importante: que os valores de Kc podem nos mostrar se a concentração dos reagentes e a dos produtos são iguais ou se uma é maior que a outra e, como consequência, se o equilíbrio químico está deslocado para algum sentido da reação.
Então, precisamos determinar o valor de Kc. Para tal, lembre-se de que esses cálculos são experimentais e, por isso, vamos analisar alguns exemplos de reações e os dados obtidos nelas.
Algo que serve muito de ajuda para realizar esses cálculos é escrever uma tabela semelhante à mostrada abaixo e seguir os passos mencionados nela:
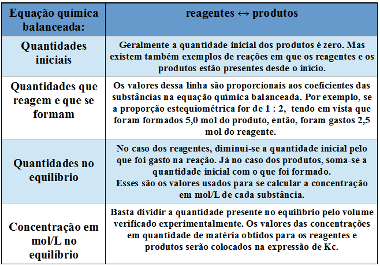
Tabela para organizar os dados usados no cálculo da constante de equilíbrio
Agora, vamos para a prática:
Exemplo 1: Em um recipiente fechado, com capacidade de 2 L, em temperatura de 100ºC, há 20 mol de N2O4. Começa a ocorrer a seguinte reação reversível: N2O4 ↔ NO2. Após certo tempo, verificou-se que a reação atingiu o equilíbrio químico e que 8 mol de NO2 haviam se formado. Qual é o valor da constante de equilíbrio Kc em temperatura de 100ºC?
Resolução:
Vamos usar a tabela:
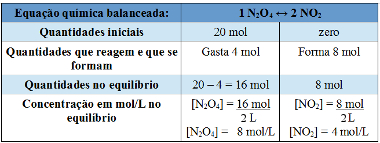
Tabela usada para resolver exemplo de cálculo da constante de equilíbrio
Observe que na linha em que foram escritas as quantidades que reagem e que se formam, sabemos que foram gastos 4 mol de N2O4, porque a proporção é de 1 : 2, e que foram formados 8 mol de NO2.
Agora basta substituir os valores encontrados na expressão da constante de equilíbrio Kc dessa reação:
Kc = [NO2]2
[N2O4]
Kc = (4 mol/L) 2
(8 mol/L)
Kc = 2 mol/L
O valor de Kc é adimensional, não possui unidade relacionada à alguma grandeza.
Agora, vejamos um exemplo, que contém também produtos desde o início:
Exemplo 2: Em um recipiente fechado, com capacidade de 5 L, em temperatura T, há 2 mol de gás hidrogênio, 3 mol de gás iodo e 4 mol de iodeto de hidrogênio . A reação entra em equilíbrio químico, em temperatura T, e verifica-se que há 1 mol de gás hidrogênio no recipiente. Qual é o gráfico que representa esse equilíbrio e qual o valor da constante de equilíbrio Kc em temperatura de T?
Resolução:
Usando tabela:
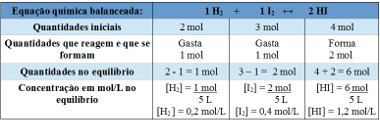
Tabela usada para determinação da constante de equilíbrio
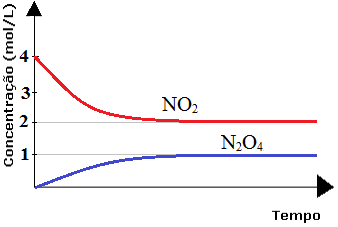
O gráfico que mostra as variações das concentrações em mol/L dos reagentes e dos produtos até atingirem o equilíbrio pode ser dado por:
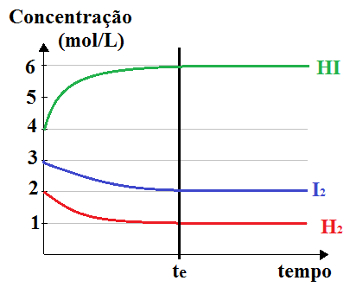
Gráfico do equilíbrio químico que mostra as variações das concentrações dos reagentes e dos produtos
Agora descobrimos o valor da constante de equilíbrio:
Kc =__2__
[H2 ] . [I2]
Kc = (1,2)2
0,2 . 0,4
Kc = 18
Por Jennifer Fogaça
Graduada em Química