O equilíbrio químico no Enem é cobrado conforme mostra o tópico “Transformação Química e Equilíbrio” da Matriz de Referência do Enem. O equilíbrio químico é uma situação que ocorre em reações reversíveis, em que a velocidade do sentido direto da reação é igual à velocidade do sentido inverso da reação. Como consequência, as quantidades das espécies participantes se tornam constantes ao longo do tempo.
São diversos tópicos importantes que estruturam esse campo do conhecimento, como a constante de equilíbrio, os equilíbrios ácido-base e iônico, a compreensão da escala pH, assim como a hidrólise salina e o deslocamento de equilíbrio (princípio de Le Chatelier).
Leia também: Como os cálculos estequiométricos são cobrados no Enem?
Tópicos deste artigo
- 1 - Resumo sobre equilíbrio químico no Enem
- 2 - Como o equilíbrio químico é cobrado no Enem?
- 3 - O que é o equilíbrio químico?
- 4 - Conceitos importantes sobre o equilíbrio químico para o Enem
- 5 - Questões sobre equilíbrio químico no Enem
Resumo sobre equilíbrio químico no Enem
-
O equilíbrio químico no Enem é cobrado conforme mostra o tópico “Transformação Química e Equilíbrio” da Matriz de Referência do Enem.
-
O equilíbrio químico é uma condição que ocorre em reações reversíveis, em que as velocidades das reações do sentido direto e inverso ficam iguais.
-
Sistemas em equilíbrio não apresentam variação na composição, tendo a concentração dos participantes constantes.
-
Entre os principais pontos de estudo estão a caracterização de um equilíbrio químico, o entendimento da constante de equilíbrio, o produto iônico da água, o pH, o equilíbrio ácido-base, a hidrólise salina e o deslocamento de equilíbrio químico.
Como o equilíbrio químico é cobrado no Enem?
No anexo da Matriz de Referência do Enem, disponibilizada pelo Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira (Inep), constam os objetos de conhecimentos. Na parte de Química, vê-se citação ao equilíbrio químico em:
Transformação Química e Equilíbrio - Caracterização do sistema em equilíbrio. Constante de equilíbrio. Produto iônico da água, equilíbrio ácido-base e pH. Solubilidade dos sais e hidrólise. Fatores que alteram o sistema em equilíbrio. Aplicação da velocidade e do equilíbrio químico no cotidiano. |1|
O que é o equilíbrio químico?
Em um processo químico reversível, ou seja, uma reação que pode ocorrer tanto no sentido direto (formação de produtos) quanto no sentido inverso (reposição de reagentes), o equilíbrio químico pode ser entendido como o momento em que as reações químicas que ocorrem no sentido direto e inverso atingem a mesma velocidade. Por consequência, as concentrações das espécies presentes no sistema se tornam constantes ao longo do tempo.
O equilíbrio químico é dinâmico, ou seja, a reação não necessariamente termina, mas sim deixa de apresentar variação na quantidade dos participantes, uma vez que as velocidades de consumo de reagentes para formação de produtos e consumo de produtos para reposição de reagentes é a mesma. Toda reação em equilíbrio é representada por uma dupla meia seta (⇌), como no equilíbrio hipotético a seguir.
A + B ⇌ C + D
Entende-se que o sentido direto é o da reação de A com B para formar C e D, enquanto o sentido inverso é o da reação entre C e D para formar A e B.
Conceitos importantes sobre o equilíbrio químico para o Enem
Baseados da Matriz de Referência do Enem, podemos citar os principais tópicos de conhecimento acerca de equilíbrio químico que requerem atenção por parte dos candidatos:
-
Caracterização de um equilíbrio químico: saber identificar quando a reação está em equilíbrio químico (seja pela equalização das velocidades reacionais, seja pela não alteração das concentrações dos participantes).
-
Constante de equilíbrio (K): a constante K é calculada pelo quociente da concentração dos produtos pela concentração dos reagentes no equilíbrio químico.
\(K = \frac{}{} \)
-
Produto iônico da água: é a ideia de que a água, mesmo em pequena proporção, apresenta uma reação de autoionização, caracterizada pelo equilíbrio a seguir:
H2O (l) ⇌ H+ (aq) + OH− (aq)
Para esse equilíbrio, estabelece-se a constante de equilíbrio Kw que é igual ao produto das concentrações de H+ e OH− no equilíbrio. Na temperatura de 25 °C o valor de Kw é igual a 1,0 x 10−14 mol2.L−2.
-
Equílibrio ácido-base: entende-se que ácidos/bases fortes se ionizam/se dissociam por completo, não apresentando reversibilidade no processo químico. Já ácidos e bases fracos, não, havendo reversibilidade no processo e estabelecendo equilíbrio químico entre as espécies não ionizada e ionizada, no caso dos ácidos, e as espécies não dissociadas e dissociadas, no caso das bases. Para tal tema, deve-se aplicar os conceitos ácido-base de Arrhenius, Bronsted-Lowry e Lewis, além de conhecer as constantes Ka e Kb e, por conseguinte, o pKa e o pKb.
-
pH: a escala pH é de suma importância, pois ela é utilizada para caracterizar se um sistema é ácido ou básico.
-
Hidrólise salina: o tema é importante para saber se sais, ao se dissociarem, apresentarão caráter ácido ou básico, assim alterando o valor de pH e interferindo em outros processos.
-
Deslocamento de equilíbrio químico: é o chamado princípio de Le Chatelier, capaz de enunciar os fatores responsáveis por alterar um sistema em equilíbrio químico. Sabe-se que são capazes de deslocar um equilíbrio alterações na concentração, na pressão e na temperatura.
O conhecimento desses temas permite que o aluno consiga aplicar os conceitos de equilíbrio em situações cotidianas, contemplando, por completo, o objeto de conhecimento proposto pela Matriz de Referência do Inep.
Veja também: Como as forças intermoleculares são cobradas no Enem?
Questões sobre equilíbrio químico no Enem
Questão 1
(Enem PPL 2022) Solos ácidos apresentam baixo valor de pH, e o plantio de culturas nesse meio acarreta baixa produção agrícola. Entretanto, esse problema pode ser contornado adicionando-se substâncias que, ao entrarem em contato com a água, liberam íons OH−, que neutralizam os íons H3O+ presentes no solo e elevam o seu pH. Para esse objetivo, um agricultor tem comercialmente à disposição as espécies químicas enumeradas:
I – KCl II – MgO III – NH4Br IV – AlCl3 V – P2O5
Para a correção do pH desse solo, o agricultor deverá utilizar a espécie química indicada pelo número
A) I.
B) II.
C) III.
D) IV.
E) V.
Resolução:
Alternativa B.
O sal KCl, ao ser dissolvido, forma os íons K+ e Cl−, ambos são eletrólitos fortes (oriundos de ácidos ou bases fortes) e, assim, são incapazes de reagir com o H+ ou OH− presentes, portanto não interferindo no pH.
Já o NH4Br e o AlCl3 são sais cujos ânions (Br− e Cl−) são eletrólitos fortes, mas os cátions (Al3+ e NH4+) são eletrólitos fracos. Assim, ao haver a dissolução, tais cátions reagem com a água por meio de hidrólises e aumentam a concentração dos íons H+, assim não auxiliando para o aumento do pH (diminuição da acidez):
Al3+ + 3 H2O ⇌ Al(OH)3 + 3 H+
NH4+ + H2O ⇌ NH4OH + H+
O P2O5 é um óxido ácido que, ao reagir com a água, forma um ácido:
P2O5 + 3 H2O → 2 H3PO4
H3PO4 ⇌ 3 H+ + PO43−
O MgO, ao contrário, é um óxido básico e, por isso, ao reagir com a água forma uma base, capaz de neutralizar os íons H+.
MgO + H2O → Mg(OH)2
Mg(OH)2 → Mg2+ + 2 OH−
Questão 2
(Enem Digital 2021) No cultivo por hidroponia, são utilizadas soluções nutritivas contendo macronutrientes e micronutrientes essenciais. Além dos nutrientes, o pH é um parâmetro de extrema importância, uma vez que ele afeta a preparação da solução nutritiva e a absorção dos nutrientes pelas plantas. Para o cultivo de alface, valores de pH entre 5,5 e 6,5 são ideais para o seu desenvolvimento. As correções de pH são feitas pela adição de compostos ácidos ou básicos, mas não devem introduzir elementos nocivos às plantas. Na tabela, são apresentados alguns dados da composição da solução nutritiva de referência para esse cultivo. Também é apresentada a composição de uma solução preparada por um produtor de cultivo hidropônico.
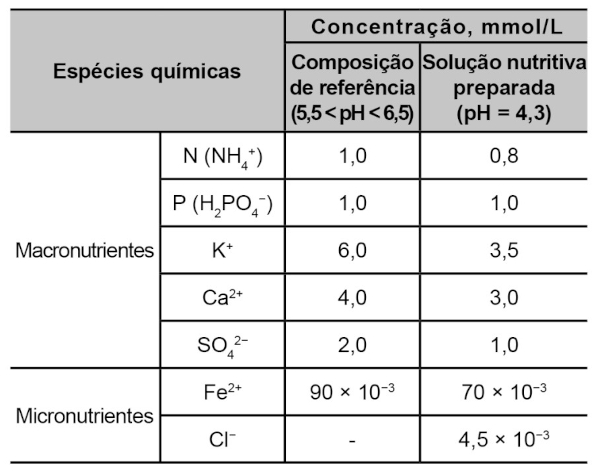
LENZI, E.; FAVERO, L. O. B.; LUCHESE, E. B. Introdução à química da água: ciência, vida e sobrevivência. Rio de Janeiro: LTC, 2012 (adaptado).
Para correção do pH da solução nutritiva preparada, esse produtor pode empregar uma solução de
A) ácido fosfórico, H3PO4.
B) sulfato de cálcio, CaSO4.
C) óxido de alumínio, Al2O3.
D) cloreto de ferro (II), FeCl2.
E) hidróxido de potássio, KOH.
Resolução:
Alternativa E.
O pH da solução nutritiva preparada é de 4,3, necessitando-se subir para um valor entre 5,5 e 6,5. Assim, deve-se alcalinizar o meio.
O ácido fosfórico não é capaz de fazê-lo, justamente por ser um ácido. O sulfato de cálcio possui íons que são eletrólitos fortes, não podendo sofrer hidrólise e, assim, não interferindo no pH.
Óxido de alumínio é um óxido de caráter anfótero, podendo se comportar como ácido ou base. Além disso, o íon Al3+ não é um nutriente interessante para o desenvolvimento do vegetal em questão.
Nessa questão, restam o cloreto de ferro (II) e o hidróxido de potássio. O KOH é uma base, capaz de alcalinizar o meio. Além disso, o íon potássio, K+, é um macronutriente para a planta, sendo mais essencial que o íon de Fe2+, um micronutriente. Vale destacar ainda que a composição de referência não contempla o íon cloreto (Cl−). A dissolução de FeCl2 faria aumentar a concentração dessa espécie, pois ele é um eletrólito forte e não seria consumido pela água presente na solução.
Questão 3
(Enem 2020) Para garantir que produtos eletrônicos estejam armazenados de forma adequada antes da venda, algumas empresas utilizam cartões indicadores de umidade nas embalagens desses produtos. Alguns desses cartões contêm um sal de cobalto que muda de cor em presença de água, de acordo com a equação química:
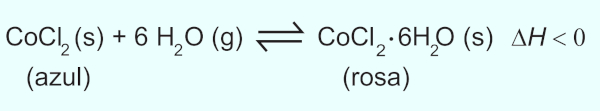
Como você procederia para reutilizar, num curto intervalo de tempo, um cartão que já estivesse com a coloração rosa?
A) Resfriaria no congelador.
B) Borrifaria com spray de água.
C) Envolveria com papel alumínio.
D) Aqueceria com secador de cabelos.
E) Embrulharia em guardanapo de papel.
Resolução:
Alternativa D.
Para reutilizar um cartão que está rosa, deve-se deslocar o equilíbrio em direção à cor azul, ou seja, deslocar o equilíbrio para a esquerda.
Como a reação de formação do cartão rosa é exotérmica, a formação do cartão azul é endotérmica. Para deslocar um equilíbrio químico na direção endotérmica, deve-se aumentar a temperatura, pois o equilíbrio se comporta para minimizar tal efeito.
Ou seja, havendo aumento de temperatura no sistema, o equilíbrio se comporta para fazer diminui-la. Para diminuir a temperatura, o equilíbrio favorece o sentido endotérmico, pois assim a reação absorve o excesso de calor do sistema, ocasionando uma queda de temperatura. Por isso, o indicado, nesse caso, é aquecer com secador de cabelo.
Questão 4
(Enem PPL 2020) A agricultura de frutas cítricas requer que o valor do pH do solo esteja na faixa ideal entre 5,8 e 6,0. Em uma fazenda, o valor do pH do solo é 4,6. O agricultor resolveu testar três produtos de correção de pH em diferentes áreas da fazenda. O primeiro produto possui íons sulfato e amônio, o segundo produto possui íons carbonato e cálcio e o terceiro produto possui íons sulfato e sódio.
O íon que vai produzir o efeito desejado de correção no valor do pH é o
A) cálcio, porque sua hidrólise produz H+, que aumenta a acidez.
B) amônio, porque sua hidrólise produz H+, que aumenta a acidez.
C) sódio, porque sua hidrólise produz OH−, que aumenta a alcalinidade.
D) sulfato, porque sua hidrólise produz OH−, que aumenta a alcalinidade.
E) carbonato, porque sua hidrólise produz OH−, que aumenta a alcalinidade.
Resolução:
Alternativa E.
O agricultor busca um íon que seja capaz de alcalinizar o meio, pois assim o pH poderá subir de 4,6 para o valor desejado, que fica entre 5,8 e 6,0.
Os íons sódio e sulfato são eletrólitos considerados fortes, não sofrendo hidrólise e, assim, não interferindo nas concentrações de H+ e OH−. Já o carbonato, um eletrólito fraco, pode sofrer hidrólise e produzir OH−:
CO32− + H2O ⇌ HCO3− + OH−
HCO3− + H2O ⇌ H2CO3 + OH−
Questão 5
(Enem PPL 2018) O sulfato de bário (BaSO4) é mundialmente utilizado na forma de suspensão como contraste em radiografias de esôfago, estômago e intestino. Por se tratar de um sal pouco solúvel, quando em meio aquoso estabelece o seguinte equilíbrio:
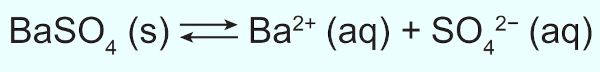
Por causa da toxicidade do bário (Ba2+), é desejável que o contraste não seja absorvido, sendo totalmente eliminado nas fezes. A eventual absorção de íons Ba2+, porém, pode levar a reações adversas ainda nas primeiras horas após sua administração, como vômito, cólicas, diarreia, tremores, crises convulsivas e até mesmo a morte.
PEREIRA, L. F. Entenda o caso da intoxicação por Celobar. Disponível em: www.unifesp.br. Acesso em: 20 nov. 2013 (adaptado).
Para garantir a segurança do paciente que fizer uso do contraste, deve-se preparar essa suspensão em
A) água destilada.
B) soro fisiológico.
C) solução de cloreto de bário, BaCl2.
D) solução de sulfato de bário, BaSO4.
E) solução de sulfato de potássio, K2SO4.
Resolução:
Alternativa E.
Para evitar a intoxicação por bário, deve-se deslocar o equilíbrio da dissolução do BaSO4 para a esquerda, no sentido de diminuir a concentração de Ba2+ presente. Tanto a água destilada quanto o soro fisiológico (solução de NaCl) não são capazes de interferir no equilíbrio, pois suas espécies não participam da reação de dissolução.
Adicionar BaCl2 e BaSO4 é colocar íons Ba2+ em solução. Por mais que o excesso de Ba2+ auxilie a deslocar o equilíbrio, tal excesso pode se mostrar perigoso no quesito intoxicação. Dessa forma, a melhor espécie a ser colocada é o K2SO4, pois a sua dissolução forma os íons K+ (inócuo e não tóxico) e SO42−. O excesso de sulfato desloca o equilíbrio de dissolução para a esquerda, aumentando a concentração de BaSO4 não dissolvido e consumindo o Ba2+ presente.
Notas
|1| BRASIL. Matriz de Referência Enem. Ministério da Educação, Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira. Disponível em: https://download.inep.gov.br/download/enem/matriz_referencia.pdf.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
BRASIL. Matriz de Referência Enem. Ministério da Educação, Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira. Disponível em: https://download.inep.gov.br/download/enem/matriz_referencia.pdf.
IUPAC GOLD BOOK. Chemical Equilibrium. Disponível em: https://goldbook.iupac.org/terms/view/C01023.