O cientista Friedrich Kohlrausch (1840-1910) foi o primeiro a propor que a água pura conduz eletricidade, ainda que em pequena escala. Isso ocorre porque a água se comporta de modo anfótero; isto é, em determinadas ocasiões ela age como ácido, doando prótons (H+); e em outras se comporta como base, recebendo prótons.
Isso significa que a água realiza a sua própria ionização, conforme a equação química representada a seguir:
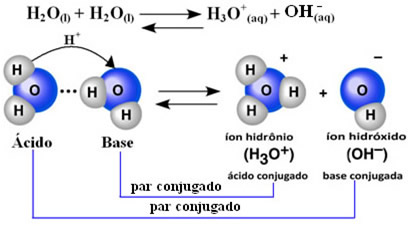
Esse processo é denominado autoionização da água e ocorre em escala muito pequena, ou seja, a água é um eletrólito muito fraco, com valores baixos de grau de ionização e de constante de ionização no equilíbrio (Kc). É exatamente por isso que a água possui condutividade tão baixa.
Para se ter uma ideia, na temperatura ambiente de 25ºC é possível determinar que as concentrações dos íons hidróxido e hidrônio produzidos na autoionização da água pura são iguais a 1 . 10-7 mol . L-1. Isso quer dizer que de um bilhão de moléculas de água, somente duas se ionizam.
A constante do equilíbrio iônico da água é denominada constante de dissociação da água, constante de autoprotóliseou produto iônico da água.Essa constante é representada por Kw, porque o w se refere à palavra water, que em inglês significa água.
Seu cálculo é feito da mesma forma que as outras constantes de equilíbrio, lembrando que, conforme dito no texto “Constantes de Equilíbrio Kc e Kp”, nesse caso, somente os produtos irão aparecer na expressão, porque a água no estado líquido tem atividade igual a 1. Substâncias líquidas puras ou sólidas não são colocadas na expressão da constante de dissociação porque elas não sofrem variação. Colocam-se apenas soluções aquosas e gasosas. Assim, temos:
Kw = [H3O+] . [OH-]
Kw = (1 . 10-7) . (1 . 10-7)
Kw = 10-14
Assim como as outras constantes de equilíbrio, o Kw só se altera com a mudança de temperatura. À medida que a temperatura da água aumenta, a sua ionização também cresce, o que significa que a autoionização da água é um processo endotérmico, isto é, que absorve calor.
Isso pode ser visto nos valores do produto iônico da água (Kw) dados na tabela abaixo em diferentes temperaturas:
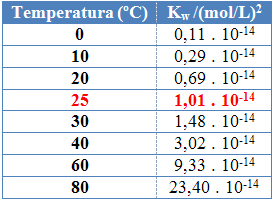
O produto iônico da água sempre terá um valor fixo em cada uma das temperaturas, seja em água pura ou em solução. Mesmo se a solução apresentar concentrações dos íons H3O+ e OH- diferentes, o produto entre eles permanecerá constante.
Por Jennifer Fogaça
Graduada em Química
