Base é toda substância que, em solução aquosa, sofre dissociação liberando íons OH-.
As bases podem ser classificadas quanto ao número de hidroxilas que as compõe, pela solubilidade ou ainda pelo grau de dissociação.
Número de hidroxilas
Monobase: apresenta um único grupo OH-. Exemplo: KOH (hidróxido de potássio).
Dibase: se caracteriza pela presença de dois grupos OH-. Exemplo: Mg(OH)2 (hidróxido de magnésio).
Tribase: a presença de três grupos OH- caracteriza essa base. Exemplo: Al(OH)3 (hidróxido de alumínio).
Tetrabase: essa base conta com quatro grupos OH- em sua composição. Exemplo: Pb(OH)4 (hidróxido de chumbo).
Solubilidade em água
Para classificar as bases usando este critério podemos tomar como princípio a ordem crescente de basicidade dada aos metais:
![]()
As bases compostas por metais alcalinos são solúveis, as de metais alcalino-terrosos são poucos solúveis e as de outros metais são praticamente insolúveis. Exemplos:
- base solúvel: LiOH - hidróxido de lítio.
- base pouco solúvel: Ca (OH)2 - hidróxido de cálcio.
- base insolúvel: Fe (OH)3 - hidróxido de ferro.
Observação: essa regra é eficiente para a classificação quanto à solubilidade em água, uma vez que existe apenas uma substância básica que não é formada por metais, o hidróxido de amônio (NH4OH).
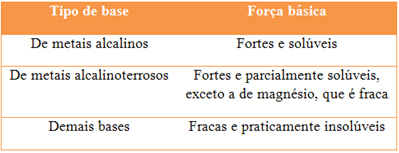
Grau de dissociação
Essa propriedade das bases se relaciona com a sua solubilidade: quanto mais solúvel for uma base maior será seu grau de dissociação. Esse princípio permite classificar as bases como sendo fortes ou fracas, veja no esquema a seguir:

Exemplo de base fraca: NH4OH (hidróxido de amônio)
Exemplo de base forte: Ba(OH)2 (hidróxido de bário), NaOH (hidróxido de sódio).
A força da base determina seu comportamento em meio à eletrólise: bases fortes constituem bons eletrólitos, já as bases fracas são maus eletrólitos.
Por Líria Alves
Graduada em Química