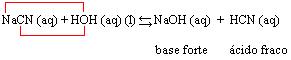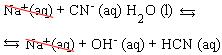PUBLICIDADE
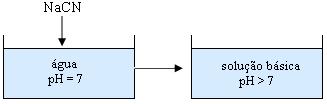
No preparo de uma solução aquosa de NaCN (cianeto de sódio), verificamos que seu pH é maior que 7, portanto constitui uma base forte. Acompanhe a análise da hidrólise deste sal:
Ao se adicionar a base NaCN em meio neutro (água), ela torna a solução básica (pH > 7).
A equação clássica do processo é:
Os produtos da reação são:
NaOH (hidróxido de sódio): base forte
HCN (ácido cianídrico): ácido fraco
As duas regras a seguir são úteis para se obter a equação do processo de Hidrólise do sal:
1. Dissociar o sal (separar o cátion do ânion)
2. Dissociar a base forte (COH → C+ +OH-)
• NaCN, por ser sal solúvel, encontra-se dissociado:
NaCN → Na+ + CN-
• NaOH, por ser base forte, encontra-se dissociada:
NaOH → Na+ + OH-
Assim, a maneira mais correta de representar a reação é:
CN- (aq) + H2O(l) ↔ OH- (aq) +HCN(aq)
Repare que a hidrólise (quebra da molécula através da água) foi do ânion CN-, ou seja, do íon proveniente do ácido fraco.
Equação genérica da Hidrólise do ânion: A- + HOH → HA + OH-
Conclusão: sal de ácido fraco e base forte dá à solução caráter básico (pH > 7). A presença do íon OH- justifica o meio básico.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Veja mais!
Hidrólise salina de ácido forte e base fraca
Hidrólise salina
Físico-Química - Química - Brasil Escola