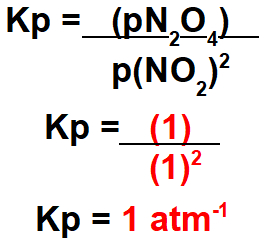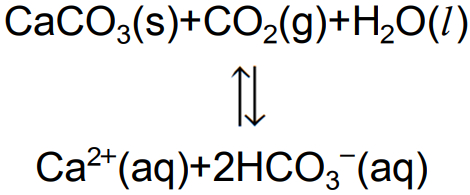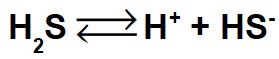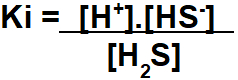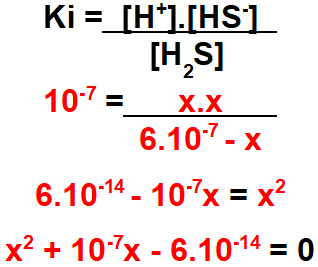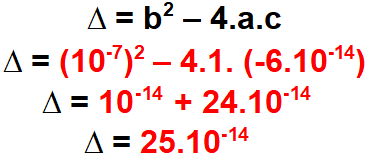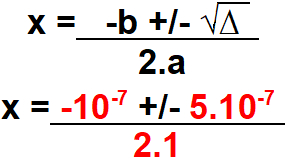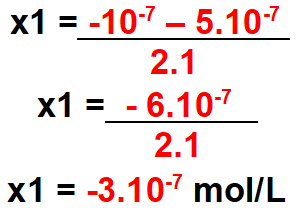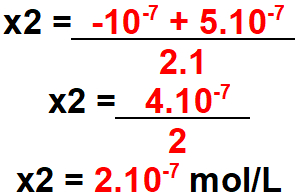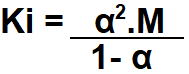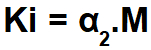Neste material, você irá acompanhar resoluções passo a passo e justificativas das respostas de diversos exercícios sobre equilíbrio químico, os quais abrangem vários tópicos desse importante ramo da Físico-Química.
1- Constante do equilíbrio em termos de concentração em mol/L
Exemplo: (PUC-RS) Um equilíbrio envolvido na formação da chuva ácida está representado pela equação:
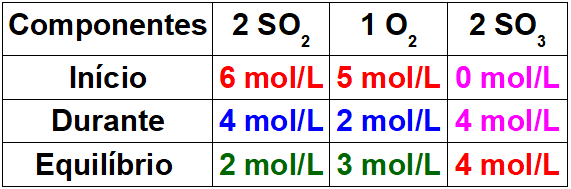
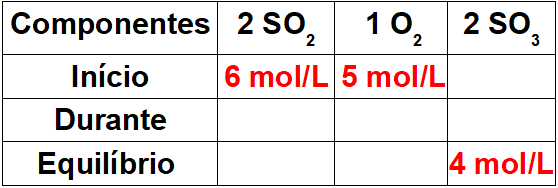
Em um recipiente de um litro, foram misturados 6 mols de dióxido de enxofre e 5 mols de oxigênio. Depois de algum tempo, o sistema atingiu o equilíbrio, e o número de mols de trióxido de enxofre medido foi 4. O valor aproximado da constante de equilíbrio é:
a) 0,53
b) 0,66
c) 0,75
d) 1,33
e) 2,33
Resposta correta: Letra D
O exercício pede para calcular a constante de equilíbrio em termos de concentração mol/L. Para esse cálculo ser realizado, devemos utilizar valores no equilíbrio de cada participante da reação. A expressão do Kc apresenta o resultado da multiplicação das concentrações dos produtos dividido pelo produto das concentrações dos reagentes:
Devemos ter muito cuidado para determinar os valores de cada participante no equilíbrio, pois nem sempre o exercício fornecerá esses dados, como é o caso desse exemplo. Assim, devemos seguir os passos abaixo:
Passo 1: Montar uma tabela com os valores conhecidos.
Por ser o início da reação, o produto irá apresentar uma concentração igual a zero. Como o valor do equilíbrio no produto é sempre igual à soma do início e do durante, o valor durante a reação será 4 mol/L.
Passo 2: Determinar os valores durante a reação.
Para determinar os valores dos reagentes durante a reação, basta relacionarmos o valor conhecido para o produto com os valores dos reagentes por meio da proporção estequiométrica. Temos 4 mol/L de SO3 durante a reação para a proporção 2 no balanceamento. Como a proporção do SO2 também é 2, teremos 4mol/L durante o processo. Para o O2, teremos apenas 2 mol/L, pois seu coeficiente estequiométrico é 1.
Para finalizar a tabela, basta subtrairmos o valor do início pelo valor do durante, pois, assim, determinaremos os valores do equilíbrio para os reagentes.
Passo 3: Determinar o valor do Kc.
Para determinar o valor do Kc, basta utilizarmos os valores encontrados no equilíbrio na expressão abaixo:
2- Constante do equilíbrio em termos de pressão parcial
Exemplo: (SANTOS-SP) Observe a equação de equilíbrio abaixo:
Quando o equilíbrio acima é alcançado, a pressão é 2 atm e há 50% de NO2 em volume. O valor da constante de equilíbrio em pressões parciais (Kp) deve ser:
a) 0,2
b) 0,25
c) 1
d) 0,5
e) 0,75
Resposta correta: Letra C
O exercício indica que a pressão total do sistema no equilíbrio é de 2 atm e que há 50% (fração molar) de NO2. Logo, inicialmente, devemos determinar a pressão parcial para cada gás no equilíbrio por meio da multiplicação da pressão total pela fração molar:
-
Para o NO2:
pNO2 = 0,5 . 2
pNO2 = 1 atm
-
Para o N2O4: como no sistema existem apenas dois gases, a porcentagem do N2O4 também será de 50% para resultar um total de 100%.
pN2O4 = 0,5 . 2
pN2O4 = 1 atm
A constante de equilíbrio, em termos de pressões parciais, é calculada dividindo o resultado da multiplicação das pressões parciais dos produtos gasosos pelo produto das pressões dos reagentes gasosos. No caso, a expressão do Kp será:
3- Deslocamento do equilíbrio
Exemplo: (PUCCAMP) A formação de estalactites, depósitos de carbonato de cálcio existentes em cavernas próximas a regiões ricas em calcário, pode ser representada pela seguinte reação reversível:
Observe as seguintes condições :
I. Evaporação constante da água
II. Corrente de ar frio e úmido
III. Elevação da temperatura no interior da caverna
IV. Abaixamento da temperatura no interior da caverna
Quais dessas condições favorecem a formação de estalactites?
a) I e II
b) I e III
c) II e III
d) II e IV
e) III e IV
Resposta correta: Letra B
As estalactites são estruturas formadas por carbonato de cálcio (CaCO3). O enunciado questiona quais das condições indicadas favorecem a formação de estalactites. Trata-se, portanto, de um exercício sobre deslocamento de equilíbrio, pois a formação do CaCO3 ocorre quando o equilíbrio é deslocado para seu sentido (para a esquerda).
I- Verdadeira, pois, ao evaporar, a quantidade de água (presente à esquerda do equilíbrio) diminui. De acordo com o princípio de Le Chatelier, quando a concentração de um participante diminui, o equilíbrio sempre desloca para seu lado.
II- Falsa, pois as cavernas são lugares frios e úmidos, logo a reação direta de formação das estalactites é exotérmica. Se uma corretente de ar frio e úmido, que favorece o processo exotérmico e aumenta a quantidade de água, entrar na caverna, a reação será deslocada no sentido direto, não favorecendo a formação das estalactites.
III- Verdadeira, pois, como as cavernas são lugares frios e úmidos e a reação direta é exotérmica, se a temperatura na caverna aumentar, a reação será deslocada no sentido indireto (endotérmico), o que favorecerá a formação das estalactites.
IV- Falsa, pois, como as cavernas são lugares frios e úmidos e a reação direta é exotérmica, se a temperatura na caverna diminuir, a reação será deslocada no sentido direto (exotérmico), o que não favorecerá a formação das estalactites.
Veja também: Equilíbrio químico nas cavernas
4- Constante de ionização
Exemplo: (UECE) A concentração [H+] de uma solução 6×10-7 mol/litro do ácido H2S, com uma constante de ionização Ki de 10-7, é igual a:
a) 5×10-7 mols/litro
b) 6×10-7 mols/litro
c) 3×10-6 mols/litro
d)2×10-7 mols/litro
Resposta correta: Letra D
Como temos apenas um ácido ou uma base, trata-se de um exercício sobre constante de ionização (Ki). Assim, para resolver esse tipo de questão, devemos conhecer as concentrações dos íons e do eletrólito (ácido ou base).
Para iniciarmos a resolução de um exercício sobre constante de ionização, devemos usar a equação de ionização do ácido (no caso do exercício, H2S) ou da base.
De acordo com a equação montada, a concentração de H+ é igual à de HS- no equilíbrio em decorrência da proporção estequiométrica. Como não conhecemos esses valores, utilizaremos x para ambas as concentrações.
Obs.: podemos utilizar x para ambas as concentrações porque estamos tratando do produto.
Passo 1: Montar a expressão do Ki.
A montagem da expressão da constante do equilíbrio de ionização segue o mesmo princípio da constante em termos de concentração em mol/L.
Passo 2: Utilizar os valores fornecidos pelo exercício na expressão do Ki montada.
Passo 3: Calcular o valor de delta.
Passo 4: Calcular o valor x possível para o delta encontrado.
-
Para x1
Obs.: a concentração não pode ser negativa. Assim, esse valor não é válido.
-
Para x2
5- Lei de diluição de Ostwald
Exemplo: (ITA) Numa solução aquosa 0,100 mol/L de um ácido monocarboxílico a 25°C, o ácido está 3,7% dissociado após o equilíbrio ter sido atingido. Assinale a opção que contém o valor correto da constante de dissociação desse ácido nessa temperatura.
a) 1,4
b) 1,4×10-3
c) 1,4×10-4
d) 3,7×10-2
e) 3,7×10-4
Resposta correta: Letra C
Por meio da lei de diluição de Ostwald, calculamos a constante de ionização (Ki) de um eletrólito forte (α é maior que 5%) por meio da fórmula:
Para calcularmos a contante de ionização de um eletrólito fraco (α é menor que 5%), usamos a seguinte fórmula:
Um exercício sobre a lei de diluição de Ostwald é facilmente reconhecido por apresentar uma concentração em mol/L (no caso 0,100 mol/L) de um único eletrólito (ácido monocarboxílico), uma porcentagem de dissociação (α = 3,7%) ou a constante de dissociação ou ionização (Ki).
Como o ácido é fraco, logo:
6- Equilíbrio químico envolvendo pH e pOH
Exemplo: (PUC-MG) Em três recipientes X, Y e Z estão contidas soluções básicas desconhecidas de concentração 0,1 mol/L. Medindo o pH das três soluções com papel indicador universal, obtiveram-se os seguintes valores, respectivamente: pH = 8, pH = 10 e pH = 13. Assinale a afirmativa CORRETA:
a) A concentração de OH- da base Z é igual a 10-13 mol/L.
b) Kb da base X é maior que Kb da base Y.
c) A base Y conduz melhor a corrente elétrica do que a base Z.
d) A base X está completamente ionizada.
e) No frasco Z, está contida uma base forte.
Resposta correta: Letra E
Para iniciar a resolução desse exercício, é necessário lembrar alguns pontos importantes:
-
Primeiro: pH + pOH = 14
-
Segundo: quanto maior o pH, com relação ao valor 7, mais básica será a solução. Quanto mais básica for a solução, maior será a concentração de ânions hidróxido [OH-].
Anuncie aqui -
Terceiro: [OH-] = 10-pOH
-
Quarto: quanto menor o pOH, maior será o Kb, ou seja, mais ionizada ou dissociada será a base.
Assim, com base nesses conhecimentos, basta seguirmos o passo a passo abaixo para resolver a questão:
Passo 1: Determinar o pOH de cada uma das soluções.
Para solução X:
pH + pOH = 14
8 + pOH = 14
pOH = 14 – 8
pOH = 6
Para solução Y:
pH + pOH = 14
10+ pOH = 14
pOH = 14 – 10
pOH = 4
Para solução Z:
pH + pOH = 14
13 + pOH = 14
pOH = 14 – 13
pOH = 1
Passo 2: Para julgarmos a alternativa A, devemos determinar a concentração de hidróxido para a solução Z.
[OH-] = 10-pOH
[OH-] = 10-1 mol/L,
Logo, a alternativa A é falsa.
Passo 3: Comparar o Kb da base X com o da base Y.
O Kb da base X é menor que o Kb da base Y, porque seu pOH é maior. Logo, a alternativa B é falsa.
Passo 4: Associar o pOH com força e dissociação.
A condução de corrente elétrica ocorre melhor em soluções que possuem um eletrólito forte de maior pOH. A base Y não conduz melhor a corrente elétrica do que a base Z, porque seu pOH é menor, logo menos íons são liberados. Assim, a alternativa C é falsa.
Passo 5: Relacionar pOH com dissociação.
Quanto menor o pOH, mais dissociada é a base. Como a solução de maior pOH está no recipiente X, nele está a solução menos dissociada. Por isso, a alternativa D é falsa.
Veja também: O pH da boca e a deterioração dos dentes
7- Solução-tampão
Exemplo: (UFES) O pH do sangue humano é mantido dentro de um estreito intervalo (7,35 - 7,45) por diferentes sistemas tamponantes. Aponte a única alternativa que pode representar um desses sistemas tamponantes:
a) CH3COOH / NaCl
b) HCl / NaCl
c) H3PO4 / NaNO3
d) KOH / KCl
e) H2CO3 / NaHCO3
A resposta para essa questão é a alternativa E, porque se trata de um exercício sobre solução-tampão ou sistema tamponante. Essa solução remete a um equilíbrio químico formado por uma mistura de duas soluções: um ácido (no exercício, o H2CO3) ou base fracos e um sal que apresente um mesmo componente do ácido (no exercício, o NaHCO3) ou da base.
a- Falsa, porque é uma mistura formada por um ácido fraco e um sal que não apresenta componente do ácido.
b- Falsa, porque é uma mistura formada por um ácido forte, já que o HCl é um dos três hidrácidos fortes (os outros são HBr e HI).
c- Falsa, porque é uma mistura formada por um ácido moderado e um sal que não apresenta componente do ácido.
d- Falsa, porque é uma mistura formada por uma base forte (apresenta elemento da família dos metais alcalinos).
Veja também: Solução-tampão no sangue humano
Por Me. Diogo Lopes Dias

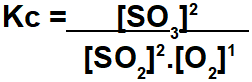
.jpg)