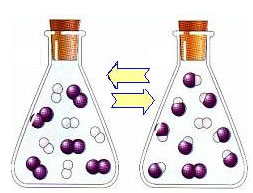
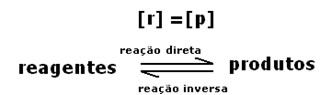
O equilíbrio dinâmico ou equilíbrio químico de uma reação ocorre quando as reações direta e inversa ocorrem simultaneamente. Esses sistemas denominados reversíveis são representados pelas setas nos dois sentidos:  ou
ou  . Um exemplo de reação reversível é citado na imagem acima, entre o gás iodo e o gás hidrogênio.
. Um exemplo de reação reversível é citado na imagem acima, entre o gás iodo e o gás hidrogênio.
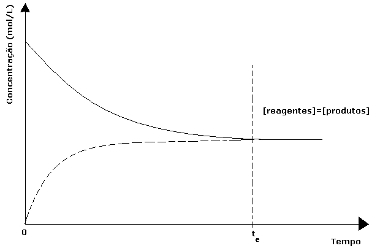
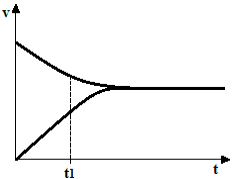
No início da reação, a quantidade de reagentes é máxima e a de produtos é zero. No entanto, os reagentes reagem entre si, diminuindo sua concentração e aumentando as dos produtos formados. A taxa de desenvolvimento da reação direta também vai diminuindo.
À medida que a concentração dos produtos vai aumentando, a reação inversa tem início e os reagentes são novamente formados; a taxa de desenvolvimento da reação inversa vai aumentando também.
Ao atingir o equilíbrio químico, à temperatura constante, as taxas de desenvolvimento das reações direta e inversa se igualam.
Tddireta = Td inversa
As taxas são iguais, mas as concentrações não. As concentrações dos reagentes e dos produtos dificilmente serão iguais. Somente em casos raros isto ocorre. Na maioria das vezes a concentração dos reagentes será maior que a dos produtos ou vice-versa.
Desse modo, temos três possíveis modos de representar graficamente as taxas de desenvolvimento das reações direta e inversa, relacionando as concentrações dos reagentes e produtos com o passar do tempo. Vejamos cada caso:
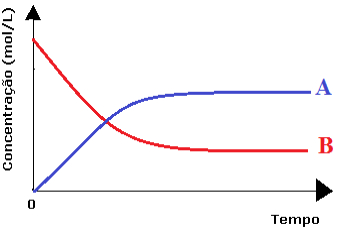
1º caso: Concentrações iguais:
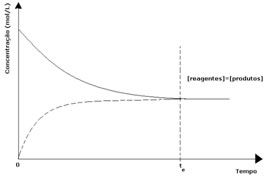
Conforme se observa no gráfico, no instante te as reações direta e inversa se igualam, e, nesse caso, as concentrações dos reagentes e dos produtos são as mesmas. Assim, o equilíbrio não está deslocado para nenhum lado, a intensidade de ambas as reações é a mesma, conforme é expresso a seguir:
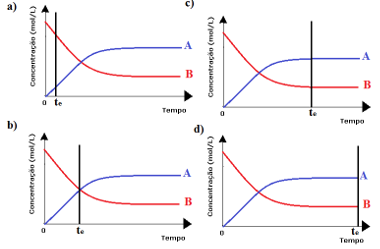
2º caso: Concentração dos reagentes maior que concentração dos produtos:
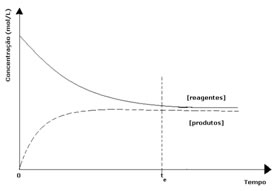
Já nesse caso, observa-se que ao atingir o equilíbrio, a concentração dos reagentes é maior que a dos produtos. Desse modo, conclui-se que se há mais reagente, a reação inversa está ocorrendo com maior intensidade. A reação está deslocada para a esquerda:
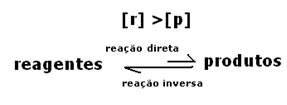
3º caso: Concentração dos produtos maior que dos reagentes:
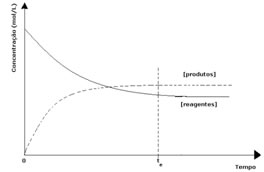
Visto que no equilíbrio a concentração dos produtos está maior, isto significa que a reação está deslocada para a direita, porque a reação direta (com formação dos produtos) ocorre com maior intensidade.
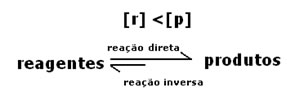
O que indicará se a reação tende para a direita ou para a esquerda será a constante de equilíbrio K, que só depende da temperatura.
Por Jennifer Fogaça
Graduada em Química
Equipe Brasil Escola