Uma solução-tampão é uma mistura usada para evitar que o pH ou o pOH do meio sofra variações quando for adicionado ácidos fortes ou bases fortes.
Existem dois tipos de solução-tampão:
1. Mistura de ácido fraco com sua base conjugada;
2. Mistura de base fraca com seu ácido conjugado.
Vejamos exemplos de cada uma e como elas atuam quando é adicionada ao meio uma pequena quantidade de ácido ou base fortes:
1. Mistura de ácido fraco com sua base conjugada:
Para a formação de uma solução assim, mistura-se o ácido fraco com um sal do mesmo ânion desse ácido.
Por exemplo, considere uma solução-tampão constituída de ácido acético (H3CCOOH(aq)) e acetato de sódio (H3CCOONa(s)). Veja que ambos possuem o ânion acetato: (H3CCOO-(aq)). A concentração desses íons se deve praticamente à dissociação do sal, que é grande. Já a ionização do ácido é pequena.
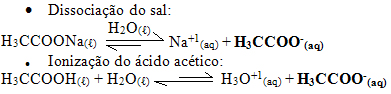
Agora observe o que ocorre nas seguintes possibilidades de adição:
- Adição de uma pequena quantidade de ácido forte:
A adição de um ácido forte aumenta a concentração do íon hidrônio, H3O+1, e visto que o ácido acético é um ácido fraco, o ânion acetato possui grande afinidade pelo próton (H+) hidrônio. Dessa forma, eles reagem e mais ácido acético é formado:
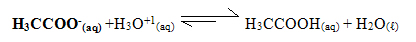
Com isso, o pH do meio praticamente não sofre alteração. No entanto, se for adicionado cada vez mais ácido forte chegará o momento em que todo o ânion acetato será consumido e o efeito tampão cessará.
- Adição de uma pequena quantidade de base forte:
A adição de uma base forte aumenta a concentração dos íons OH-. Mas esses íons são neutralizados pelos íons H3O+1 liberados na ionização do ácido acético:
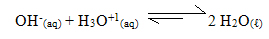
Com essa reação, a concentração dos íons H3O+1(aq) irá diminuir e haverá um deslocamento do equilíbrio no sentido de aumentar a ionização do ácido e, com isso, a variação de pH da solução será muito pequena. A concentração dos íons H3O+1(aq) será praticamente constante.
Nesse caso também existe uma capacidade limite do tampão. Portanto, se adicionarmos cada vez mais base, o equilíbrio da ionização do ácido será mais e mais deslocado no sentido da sua ionização, até que todo o ácido seja consumido.
2. Mistura de base fraca com seu ácido conjugado:
Esse tipo de solução-tampão é constituído de uma base fraca e um sal solução que contenham o mesmo cátion da base.
Por exemplo, considere uma solução-tampão formada por hidróxido de magnésio, MgOH2(aq) (base fraca) e cloreto de magnésio, MgCl2(s) (sal). Ambos contêm o cátion magnésio (Mg2+(aq)). Os íons magnésio presentes no meio são praticamente todos provenientes da dissociação do sal, pois a dissociação da base é fraca:
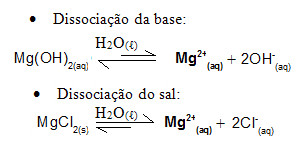
- Adição de uma pequena quantidade de ácido forte:
Nesse caso, os íons H3O+1 vindos da adição do ácido forte serão neutralizados pelos íons OH-, vindos da dissociação da base fraca. Isso deslocará o equilíbrio de dissociação da base para a direita.
Assim, a variação de pH (se houver) será muito pequena, porque a concentração dos íons OH- permanece constante. O efeito tampão irá cessar quando toda a base for dissociada.
- Adição de uma pequena quantidade de base forte:
A base forte adicionada sofre dissociação liberando íons OH-. Visto que o hidróxido de magnésio é uma base fraca, o magnésio liberado na dissociação do sal terá maior tendência de reagir com o OH-:
.jpg)
Portanto, o aumento dos íons OH- é compensada pelo aumento proporcional de Mg(OH)2(aq). Com isso o pH não sofre grandes alterações.
Esse efeito acaba quando todo cátion magnésio tiver sido consumido.
Por Jennifer Fogaça
Graduada em Química

