Princípio de Le Chatelier: quando se aplica uma força em um sistema em equilíbrio, ele tende a se reajustar no sentido de diminuir os efeitos dessa força.
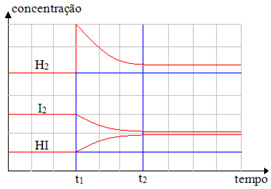
Alterações da acidez e basicidade agem como forças externas em equilíbrios químicos. O sistema precisa então se deslocar para amenizar os efeitos dessa força. Vejamos um exemplo de fator que pode alterar o equilíbrio de um sistema, a concentração.
2 CrO2-4 (aq) + 2 H+ (aq) ↔ CrO2- 7 (aq) + H 2 O (l)
Se adicionarmos algumas gotas de limão (solução ácida) neste equilíbrio, ele irá se deslocar para a direita ou para a esquerda e favorecer a formação de um dos produtos.
Isso porque através desta ação aumentamos a quantidade de íons H+ em um dos membros da equação. Se isso ocorre nos reagentes à esquerda, o equilíbrio se desloca para a direita, para se equilibrar.
A reação pode ser revertida se adicionarmos uma solução básica de NaOH ao sistema. A presença de íons OH- consome os íons H+ e o equilíbrio se desloca para a esquerda.
Conclusão: Quando a concentração de íons (CrO2-7) prevalece, o equilíbrio se desloca para esquerda. Se a concentração de íons (CrO 2-4) prevalecer, o equilíbrio se desloca para a direita.
Por Líria Alves
Graduada em Química