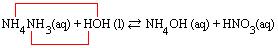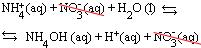PUBLICIDADE
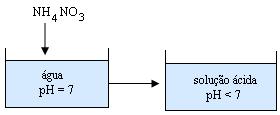
Ao preparamos uma solução aquosa de Nitrato de amônio (NH4NO3) podemos constatar que seu pH fica abaixo de 7.
A adição de NH4NH3 à água torna a solução ácida.
Para se obter a equação do processo de Hidrólise do sal, devemos seguir as seguintes regras:
• dissociar o sal (separar o cátion do ânion)
• ionizar o ácido forte (HA → H+ + A-)
• dissociar a base forte (COH → C+ + OH-)
• NH4NO3, por ser sal solúvel, encontra-se dissociado:
NH4NO3 → NH+4 + NO-3
• HNO3, por ser ácido forte, encontra-se ionizado:
HNO3 → H+ + NO-3
Assim, a maneira mais correta de representar a reação é:
Observe que a hidrólise foi do cátion, ou seja, do íon proveniente da base fraca.
Hidrólise do cátion: NH4+ + HOH ↔ NH4OH + H+
A Hidrólise salina do nitrato de amônio deu origem aos produtos:
NH4OH (hidróxido de amônio): base fraca
HNO3 (ácido nítrico): ácido forte
A presença do íon H+ justifica a acidez da solução (pH < 7).
Conclusão:
Sal de ácido forte e base fraca dá à solução caráter ácido.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Veja mais! Hidrólise salina