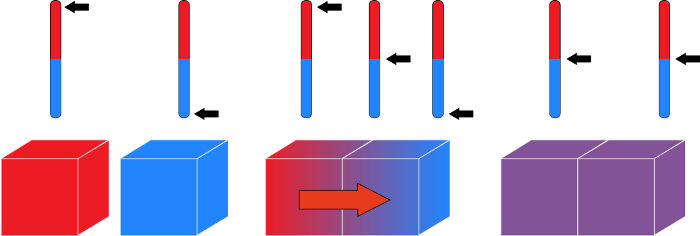
Equilíbrio térmico é a condição em que um corpo encontra-se na mesma temperatura que suas vizinhanças. Observa-se que todos os corpos que se encontram em temperaturas mais altas que seus vizinhos tendem a ceder-lhes calor de forma espontânea até que ambos passem a apresentar a mesma temperatura.
Veja também: Fundamentos da Termologia
Tópicos deste artigo
- 1 - Equilíbrio térmico e lei zero da Termodinâmica
- 2 - Calor e equilíbrio térmico
- 3 - Calor sensível
- 4 - Calor latente
- 5 - Fórmula de equilíbrio térmico
- 6 - Determinando a temperatura de equilíbrio térmico
- 7 - Experimento sobre equilíbrio térmico
- 8 - Equilíbrio térmico e vida na Terra
Equilíbrio térmico e lei zero da Termodinâmica
O equilíbrio térmico é o conceito central por trás da lei zero da Termodinâmica. Tal lei estabelece que, no caso em que dois sistemas termodinâmicos, A e B, encontrem-se em equilíbrio térmico com um terceiro sistema termodinâmico, C, então, A e B também estarão em equilíbrio térmico.
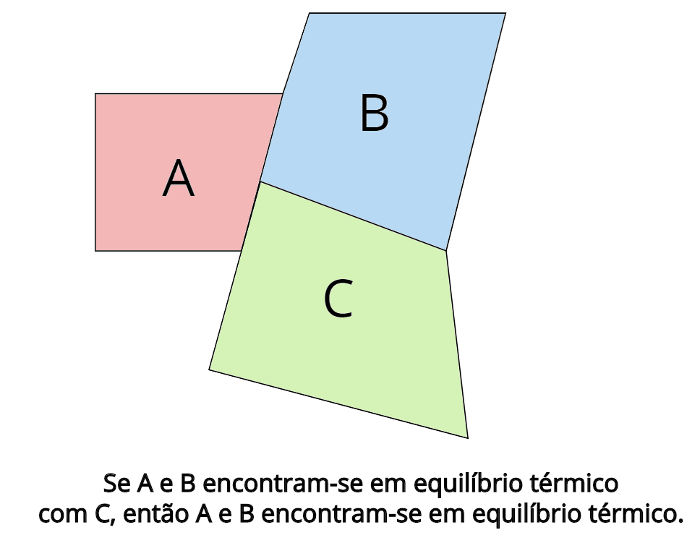
No equilíbrio térmico, as temperaturas finais de cada corpo devem ser iguais: TA = TB = TC
Confira o que estabelece o enunciado da lei zero da Termodinâmica:
“Se dois corpos encontrarem-se em equilíbrio térmico com um terceiro corpo, então, esses corpos estarão em equilíbrio térmico entre si.”
Outra forma de entendermos o equilíbrio térmico é a partir da energia interna dos corpos. A energia interna, ou simplesmente energia térmica, é uma grandeza física diretamente proporcional à temperatura do corpo. Por isso, caso haja corpos com diferentes temperaturas dentro do mesmo sistema termodinâmico, eles estarão com diferentes módulos de energia interna e, portanto, transferirão parte dessa energia entre si até que não haja nenhuma diferença entre suas energias internas. Quer saber mais sobre o que é energia interna e quais são as suas propriedades? Acesse o artigo: Energia interna.
Calor e equilíbrio térmico
A transferência de calor sempre ocorre de forma espontânea, no sentido do corpo de maior temperatura para o corpo de menor temperatura. Essa transferência de energia em forma de calor pode ocorrer por meio de processos como a condução, convecção e radiação.
-
Condução: É a transferência de calor entre corpos que ocorre especialmente em sólidos. Nesse tipo de condução, não ocorrem transferências de massa. Esse tipo de transferência de calor explica como ocorre o equilíbrio térmico em metais, por exemplo.
-
Convecção: É uma transferência de calor que ocorre em fluidos. Nessa modalidade de transferência de calor, há a transferência de massa, uma vez que o fluido aquecido move-se, formando correntes de convecção até que todo o fluido atinja o equilíbrio térmico.
-
Radiação: É a transmissão de calor por meio de ondas eletromagnéticas, portanto, esse processo ocorre mesmo que não haja um meio físico entre o corpo e outro corpo em diferentes temperaturas. O calor que é transferido, nesse caso, é o equivalente a ondas eletromagnéticas de menor energia que a luz visível, tratando-se, dessa forma, de radiações térmicas, localizadas na região do infravermelho.
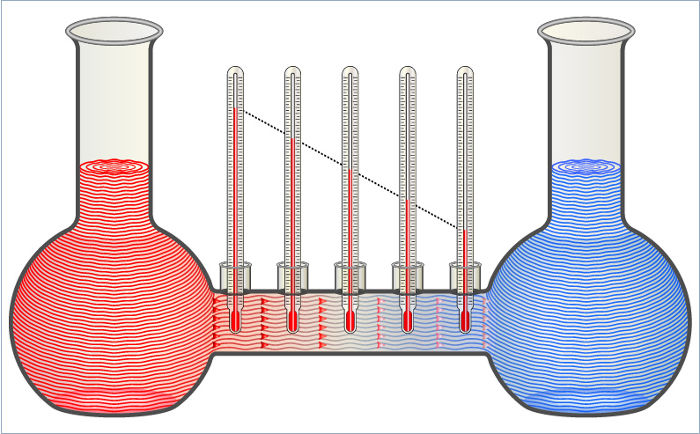
Os dois líquidos da figura transferem calor entre si até que suas temperaturas fiquem iguais.
Quer saber mais sobre como ocorrem cada um dos processos de transferência de calor? Acesse o artigo: Processos de propagação de calor.
Calor sensível
Quando há diferença de temperatura entre dois corpos, ou entre um corpo e suas vizinhanças, haverá troca de calor entre eles de forma espontânea, de modo que o corpo de temperatura mais elevada resfrie-se, e os corpos de menor temperatura aqueçam-se até que todos atinjam a temperatura de equilíbrio térmico.
A quantidade de calor que é trocada entre corpos que se encontram em diferentes temperaturas é chamada de calor sensível e essa quantidade pode ser calculada a partir da fórmula mostrada na figura abaixo:
![]()
Q – calor (cal ou J)
m – massa (g ou kg)
c - calor específico (cal/gºC ou J/kg.K)
ΔT – variação de temperatura (ºC ou K)
Na fórmula mostrada acima, é importante destacarmos a grandeza de nome calor específico. Tal grandeza mede a quantidade de energia por massa que alguma substância precisa ceder, ou absorver, para ter a sua temperatura variada em 1ºC. No caso da água pura, por exemplo, e em condições normais de pressão, para variarmos sua temperatura em 1ºC é necessário 1,0 caloria para cada grama de água.
Assim, todas as substâncias que têm contato térmico estabelecido entre si tendem a atingir a condição de equilíbrio térmico com o passar do tempo de forma espontânea, no entanto, algumas necessitam de uma maior quantidade de energia para tal e isso afeta diretamente a temperatura para atingir o equilíbrio térmico.
Leia também: O que é temperatura?
Calor latente
É possível que durante as trocas de calor com suas vizinhanças, um corpo apresente pressão, temperatura e volume que o levem a sofrer uma mudança em seu estado físico. Essas mudanças ocorrem em temperatura constante (para corpos compostos por uma única substância, sem impurezas), ou seja, apesar de estarem recebendo ou cedendo calor para o meio externo, a temperatura desses corpos não se altera.
Isso só é possível porque toda a energia trocada, nesse caso, está sendo usada para alterar a conformação de suas moléculas. A partir do momento em que se “vence” a barreira energética e todo o conteúdo do corpo encontra-se em outro estado físico, o corpo continua a troca de calor com as vizinhanças, a menos, é claro, que a sua temperatura seja igual à temperatura externa.
O calor latente pode ser calculado a partir da fórmula mostrada na figura abaixo, confira:
![]()
Q – calor latente (cal ou J)
m – massa (g ou kg)
L – calor latente específico (cal/g ou J/kg)
Fórmula de equilíbrio térmico
Caso queiramos descobrir qual é a temperatura de equilíbrio de algum sistema termodinâmico, é necessário que consideremos o sistema em questão como um sistema isolado, isto é, devemos assumir que nenhuma quantidade de calor seja trocada com as vizinhanças desse sistema.
A partir dessa condição, podemos dizer que toda a quantidade de calor trocada, é trocada somente entre os corpos que constituem esse sistema, desconsiderando as perdas de calor para as paredes do recipiente, por exemplo. Nesse caso, dizemos que o recipiente tem capacidade térmica desprezível, ou seja, ele não absorve nenhum calor.
Imagine a seguinte situação: em uma xícara de chá quente, de capacidade térmica desprezível, despeja-se alguns cubos de gelo. Para determinarmos a temperatura de equilíbrio térmico, além de conhecermos as condições iniciais do sistema, devemos fazer algumas considerações:
-
Toda a quantidade de calor que o chá quente ceder para o gelo será absorvida integralmente por ele, uma vez que a xícara tem capacidade térmica desprezível.
-
Devemos desconsiderar as perdas de calor para o ar e para quaisquer outras vizinhanças, de forma que essa xícara de chá possa ser entendida como um sistema termodinâmico fechado.
Dessa forma, podemos estabelecer que toda a quantidade de calor recebida pelo gelo foi cedida pelo chá quente, com isso, escrevemos nossa fórmula para o cálculo do equilíbrio térmico:
![]()
QR – Calor recebido
QC – calor cedido
O calor cedido (QC), diz respeito à quantidade de calor que o chá quente transferiu para os cubos de gelo nele inseridos. Já o calor recebido (QR) é a quantidade de calor que esses cubos de gelo receberam. Essa quantidade de calor terá duas naturezas: calor sensível e calor latente, uma vez que, para entrar em equilíbrio térmico, os cubos de gelo provavelmente derreterão.
Determinando a temperatura de equilíbrio térmico
Vamos determinar a temperatura de equilíbrio térmico da seguinte situação:
Uma xícara, de capacidade térmica desprezível, que contém 200 ml (200g) de chá à temperatura inicial de 70 ºC, recebe 10g de gelo à temperatura de -10 ºC. Determine a temperatura de equilíbrio térmico do sistema (considere que o calor específico do chá seja igual ao calor específico da água):
Dados:
cÁGUA = 1,0 cal/gºC
cGELO = 0,5 cal/gºC
LGELO = 80 cal/g
Primeiramente, consideramos que todo o calor recebido pelo gelo foi cedido pelo chá:
![]()
Em seguida, é necessário detalharmos quais foram as formas de calor cedidas e recebidas:
-
Chá: O chá cedeu somente calor sensível (QS), já que o seu estado físico não sofreu mudanças.
-
Gelo: O gelo estava inicialmente a -10 ºC, por isso, recebeu calor sensível (QS) até a temperatura de 0 ºC, em seguida, recebeu calor latente (QL) para liquefazer-se. Após tornar-se líquido, recebeu calor latente (QS) até entrar em equilíbrio térmico (TF) com o chá.
Traduzindo o que foi analisado acima na forma de equação, teremos o seguinte cálculo para resolver:
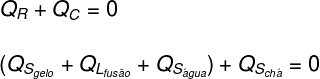
Substituindo os dados fornecidos pelo exercício na equação encontrada acima, teremos que resolver o seguinte cálculo:
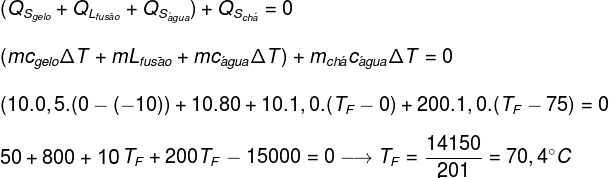
De acordo com o cálculo feito acima, a temperatura de equilíbrio do sistema chá+gelo, deve ser de aproximadamente 70,4 ºC.
Experimento sobre equilíbrio térmico
Para testarmos o equilíbrio térmico entre dois corpos, podemos realizar diversos experimentos. O mais simples deles, entretanto, envolve o uso de um calorímetro e um termômetro. O calorímetro é um recipiente adiabático (que não permite a passagem de calor), de capacidade térmica aproximadamente desprezível, como um pote revestido com isopor, por exemplo, que é um bom isolante térmico.

O calorímetro é usado para medir a variação de temperatura do sistema em seu interior.
Equilíbrio térmico e vida na Terra
O equilíbrio térmico tem um papel fundamental na vida terrestre. Sem a presença dos gases estufa na atmosfera terrestre, grande parte da radiação térmica do planeta o deixaria, propagando-se para o espaço. Com o passar do tempo, isso causaria um grande resfriamento em todo o planeta, fazendo com que os oceanos congelassem-se com o passar do tempo.
Além disso, os oceanos têm um papel fundamental no equilíbrio térmico do planeta. Em virtude de sua grande massa e calor específico, os oceanos são dotados de uma enorme capacidade térmica, isto é, precisam receber enormes quantidades de calor para ter a sua temperatura alterada. Por esse motivo, são capazes de regular de maneira muito eficiente a temperatura do planeta. Regiões distantes dos oceanos e com pouca água costumam apresentar grandes amplitudes térmicas, como no caso dos desertos, que são extremamente quentes durante o dia e congelantes durante a noite.
Portanto, o equilíbrio térmico é um processo de fundamental importância para a manutenção dos processos físicos, químicos e biológicos do planeta e, dessa maneira, imprescindível para a existência da vida na Terra.
Por Me. Rafael Helerbrock