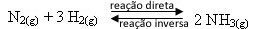
Uma reação reversível que se encontra em equilíbrio só terá o seu equilíbrio deslocado se houver alguma alteração externa, pois um equilíbrio nunca se desloca por vontade própria.
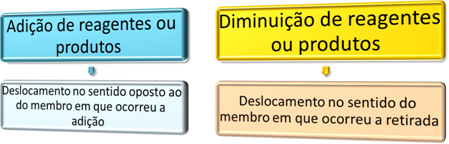
Uma dessas alterações é a variação da concentração, o que envolve retirar ou adicionar reagentes ou produtos.
Vejamos um exemplo:
- Adição de reagentes:
Se adicionarmos ao equilíbrio mais gás hidrogênio ou mais gás nitrogênio, as concentrações dos reagentes irão aumentar e, com isso, o número de choques efetivos entre suas moléculas também se elevará, resultando no aumento da taxa de desenvolvimento da reação direta de formação da amônia (NH3(g)).
Isso quer dizer que a adição de reagentes desloca o equilíbrio para o lado direito, no sentido da formação dos produtos:
.jpg)
Isso está de acordo com o Princípio de Le Chatelier que diz que quando se provoca alguma perturbação em um sistema em equilíbrio, este se desloca no sentido de anular essa perturbação, procurando se ajustar a um novo equilíbrio.
No caso acima, ocorrerá que, com o tempo, a quantidade de amônia irá aumentar, atingindo novamente um equilíbrio. Com isso, a razão entre as concentrações dos produtos e reagentes se manterá constante, ou seja, o valor da constante de equilíbrio Kc permancerá o mesmo.
Kc = __[NH3]2__↑
[N2] . [H2]3 ↑
Isso também ocorrerá para os demais casos, isto é, nenhuma variação na concentração dos reagentes ou dos produtos alterará o valor de Kc.
- Adição de produtos:
Se adicionarmos mais amônia, aumentando a sua concentração, parte dela irá se transformar nos gases nitrogênio e hidrogênio, aumentando a taxa de desenvolvimento da reação inversa de formação dos reagentes.
Isso significa que a adição de produtos desloca o equilíbrio para o lado esquerdo, no sentido de formação dos reagentes:
.jpg)
- Retirada de reagentes:
Se retirarmos um ou os dois reagentes, as suas concentrações diminuirão e, consequentemente, a taxa de desenvolvimento da reação direta irá diminuir. Assim, o equilíbrio será deslocado no sentido da formação de mais reagentes, que é para a esquerda:
.jpg)
- Retirada de produtos:
Se diminuirmos a concentração dos produtos, a taxa da reação inversa irá diminuir, aumentando a taxa de desenvolvimento da reação direta. Isso significa que o equilíbrio se deslocará para a direira:
.jpg)
Resumidamente, podemos dizer o seguinte:
É importante ressaltar que a variação da concentração de sólidos não desloca o equilíbrio.
Portanto, na reação abaixo, se retirarmos ou adicionarmos CO2(g) ou CO(g), haverá o deslocamento do equilíbrio. Mas se diminuirmos ou adicionarmos C(s), nada irá acontecer com o equilíbrio químico:
C(s) + CO2(g) ↔ 2 CO(g)
Por Jennifer Fogaça
Graduada em Química