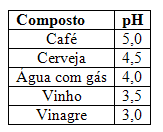
A sigla pH é utilizada para representar o potencial hidrogeniônico presente em uma determinada solução ou mistura. Esse potencial refere-se à quantidade (concentração molar ou molaridade) de cátions hidrônio (H+ ou H3O+) presentes no meio e indica se esse meio, ou mistura, é ácido, básico ou neutro.
De acordo com o estudo do equilíbrio iônico da água, além dos cátions hidrônio, temos também a presença de íons hidróxido (OH-). Assim, a avaliação do pH de um meio sempre leva em consideração a concentração de hidrônios (cátions) e a de hidróxidos (ânions).
Segundo Arrhenius, um meio que apresenta hidrônios é ácido, e o que apresenta hidróxidos é básico. Porém, devemos relacionar a quantidade de ambos os íons (H+ e OH-), o que faz a classificação de um meio seguir estes princípios:
-
Meio ácido: quantidade de hidrônios > (maior) que a de hidróxidos;
-
Meio neutro: quantidade de hidrônios = (igual) a de hidróxidos;
-
Meio básico: quantidade de hidrônios < (menor) que a de hidróxidos.
A noção sobre a caraterística de um meio é possível por meio do pH porque os químicos determinaram para esse potencial uma variação numérica de 0 a 14. Essa variação utiliza como base a constante de ionização (Kw) da água (multiplicação da concentração de H+ e OH-, Kw = [H+].[OH-]), que vale 10-14 a 25oC.
Assim, podemos classificar um meio por meio do valor do pH da seguinte maneira:
-
Para pH = 7, o meio será neutro (indica [H+] = [OH-]);
-
Para pH > 7, o meio será básico (indica [H+] < );
-
Para pH < 7, o meio será ácido (indica [H+] > [OH-]).
A determinação do valor do pH é realizada por intermédio da concentração molar de hidrônios presentes no meio. Isso é possível porque, como essa concentração é sempre muito baixa, como observado pelo valor do Kw (10-14), determinou-se que o trabalho com os íons da solução seria realizado com o cologaritmo (logaritmo com sinal contrário):
colog H+ = - logH+
Desde 1909, Peter Sorensen (químico dinamarquês) sugeriu o termo p (de potencial ou quantidade) para determinar o cologaritmo de uma variável. Assim, se estamos falando sobre o potencial hidrogeniônico, a sigla é pH e envolve a concentração de hidrônios:
pH = -log [H+]
Como o logaritmo utilizado no cálculo do pH é de base 10, podemos escrever a expressão da seguinte forma:
10-pH = [H+]
Assim, se conhecermos a molaridade de hidrônios do meio, saberemos classificá-lo. Veja um exemplo:
Exemplo 1: Concentração de H+ igual a 10-9 mol/L.
Colocamos o valor da concentração do H+ na expressão do pH:
pH = -log [H+]
pH = -log 10-9
De acordo com as propriedades logaritmicas, o expoente -9 multiplica o log de 10, que vale 1:
pH = 9.log10
pH = 9.1
pH = 9
Logo, o meio é básico.
Exemplo 2: Concentração de H+ igual a 10-4 mol/L
Vamos utilizar a expressão mais simples para o pH:
10-pH = [H+]
10-pH = 10-4
Como temos a mesma base em ambos os lados da igualdade, podemos igualar os seus expoentes e multiplicar por -1 para eliminar o sinal negativo:
-pH = -4. (-1)
pH = 4
Logo, o meio é ácido.
Por Me. Diogo Lopes Dias