A constante de ionização (representada pela sigla Ki) é a constante de equilíbrio que trata da concentração molar (quantidade em mol/L) dos íons presentes em uma solução preparada pela dissolução de um composto iônico em água.
Ela está relacionada com reações reversíveis de ionização ou dissociação de um composto iônico dissolvido em água. Os compostos iônicos que participam de reações reversíveis de ionização e dissociação são os ácidos e as bases.
a) Ionização
Quando um ácido (substância molecular que apresenta hidrogênios ionizáveis) é dissolvido em água, temos a produção de dois íons: o cátion hidrônio (H3O+ ou H+) e um ânion qualquer (X-). Assim, ocorre a formação de um equilíbrio reversível de ionização, que é representado pela seguinte equação:
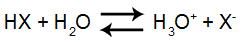
Equação de ionização do ácido
b) Dissociação
Quando uma base dissolve-se em água, temos a liberação do cátion (metal qualquer) e do ânion (OH-) que a formam. Assim, estabelece-se um equilíbrio reversível de dissociação, que é representado pela seguinte equação:
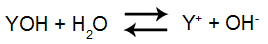
Equação de dissociação da base
c) Expressão da constante do equilíbrio (Kc)
Seja em uma ionização, seja em uma dissociação, podemos determinar a expressão do Kc. Para isso, basta multiplicar a concentração molar dos produtos no numerador e dividir pelo produto dos reagentes no denominador:
- Para a ionização:

Equação de ionização do ácido
Kc = [H3O+].[X-]
.[H2O]
- Para a dissociação:
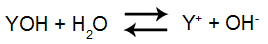
Equação de dissociação da base
Kc = [Y+].[OH-]
.[H2O]
d) Expressão da constante de ionização (Ki)
Como a água é o solvente presente em ionização de ácidos e dissociação das bases, dizemos que ela é uma constante no processo. Assim, quando realizamos o produto do Kc pela concentração molar da água, formamos uma nova constante, que é a constante de ionização. Assim:
- Para o ácido

Equação de ionização do ácido
Kc = [H3O+].[X-]
.[H2O]
Kc. [H2O] = [H3O+].[X-]
Ki = [H3O+].[X-]
Podemos utilizar ainda a sigla Ka para indicar a constante de ionização de um ácido:
Ka = [H3O+].[X-]
- Para a base
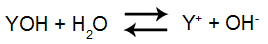
Equação de dissociação da base
Kc = [Y+].[OH-]
.[H2O]
Kc. [H2O] = [Y+].[OH-]
Ki= [Y+].[OH-]
Podemos utilizar ainda a sigla Kb ou Kd para indicar a constante de dissociação de uma base:
Kb= [Y+].[OH-]
e) Interpretação da constante de ionização (Ki)
Como a constante de ionização relaciona as concentrações dos íons (provenientes de ácido ou base) e a substância que os originou (ácido ou base), podemos utilizá-la para comparar ou prever a força do ácido e da base utilizada na água.
Ki= [Y+].[OH-]
Ou
Ki = [H3O+].[X-]
Quando:
-
Numerador maior que o denominador: indica muitos íons, logo, ácido ou base forte.
-
Numerador menor que o denominador: indica poucos íons, logo, ácido ou base moderados ou fracos.
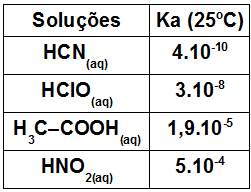
Via de regra, podemos utilizar as referências abaixo para tratar da força ácida ou básica de um eletrólito dissolvido em água a partir do valor da sua constante de ionização:
Ki > 10-3 → Ácido forte
Ki = 10-3 ou 10-4 → Ácido moderado ou semiforte
Ki ≤ 10-5 → Ácido fraco
Por Me. Diogo Lopes Dias