O volume atômico não é o volume que um átomo ocupa, mas refere-se ao volume ocupado por uma quantidade fixa de determinado número de átomos de um elemento químico.
No texto Elemento Químico, mostrou-se que um elemento corresponde a um conjunto de átomos que possuem o mesmo número atômico, isto é, a mesma quantidade de prótons no núcleo. A quantidade que se estabeleceu para calcular o volume atômico é o valor da constante de Avogadro, que é igual a 6,02 . 1023 átomos, o que corresponde a 1 mol do elemento.
Assim, podemos dizer que o volume atômico é o volume que 1 mol de átomos (ou 6,02 . 1023 átomos) de um elemento ocupa.
Essa grandeza pode ser calculada se soubermos a densidade do elemento no estado sólido e a massa de 1 mol de átomos desse elemento. Por exemplo, considere que a densidade do sódio (Na) é igual a 0,97 g/cm3 e que 6,02 . 1023 átomos de sódio têm a massa igual a 23,0 g. Podemos, então, a partir da fórmula da densidade, chegar ao volume atômico do sódio. Veja como:
densidade = massa
volume
volume atômico = massa de 6,02 . 1023 átomos do elemento
densidade do elemento no estado sólido
Volume atômico do sódio = 23,0 g
0,97 g/cm3
Volume atômico do sódio = 23,71 cm3
O valor do volume atômico envolve não só o tamanho dos átomos, mas também a distância entre eles. Portanto, visto que envolve também os espaços vazios, não podemos pegar o valor do volume atômico e dividir pela quantidade de átomos (6,02 . 1023) para descobrir o volume que cada átomo ocupa.
É importante estudar o volume atômico porque ele é uma propriedade periódica, ou seja, varia conforme o número atômico do elemento. Observe a imagem logo mais a seguir. O volume atômico dos elementos cresce de cima para baixo, o que significa que, quando analisamos os elementos pertencentes a uma mesma família da Tabela Periódica, conforme o número atômico cresce, o volume atômico também cresce. Isso ocorre porque, nesse sentido, os períodos vão aumentando, o que quer dizer que as camadas eletrônicas dos átomos vão aumentando e, consequentemente, o volume ocupado por eles também. Esse é o mesmo sentido de crescimento do raio atômico.
Por outro lado, no sentido horizontal, vemos que o volume atômico aumenta do centro para as extremidades. Quando começamos da esquerda e vamos para a direita até o meio da Tabela Periódica, o volume atômico vai diminuindo porque o período é o mesmo, ou seja, os elementos de uma mesma linha possuem a mesma quantidade de camadas eletrônicas, mas o número atômico vai aumentando. Isso quer dizer que a quantidade de elétrons aumenta nesse sentido, o que resulta em uma maior força de atração dos elétrons para com o núcleo do átomo, diminuindo seu raio atômico e, consequentemente, o volume atômico. Mas do centro para a direita, isso não continua acontecendo, porque, no caso dos elementos situados nessa região, principalmente no caso dos ametais, o espaçamento entre os seus átomos é relativamente grande, o que afeta o volume atômico, aumentando-o.
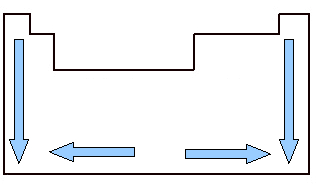
Variação do volume atômico na Tabela Periódica ao longo das famílias e períodos
Por Jennifer Fogaça
Graduada em Química
