O raio atômico (r) costuma ser definido como a metade da distância existente entre dois núcleos de átomos vizinhos, conforme a figura abaixo representa:
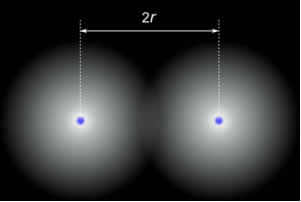
Raio Atômico
O raio atômico diferencia-se de um átomo para o outro de acordo com a sua família e período na Tabela Periódica. Com respeito a elementos pertencentes à uma mesma família, o seu raio atômico aumenta de acordo com o aumento do número atômico, ou seja, de cima para baixo. Pois, neste sentido, significa que de um átomo para o outro aumentou um nível energético ou camada eletrônica, por isso o seu raio aumenta proporcionalmente.
Já no que diz respeito à elemento em um mesmo período, ou seja, na horizontal, o raio aumenta da direita para a esquerda, ou de acordo com a diminuição do número atômico. Isto ocorre em razão de todos possuírem o mesmo número de camadas, o que diferencia é a quantidade de elétrons nessas camadas, e quanto mais elétrons maior será a atração pelo núcleo, diminuindo assim o raio do átomo.

Sentido do crescimento do raio atômico de acordo com a família e o período na Tabela Periódica
No entanto, o raio atômico pode variar de acordo com a ligação que é feita. Vejamos como isso ocorre:
*Ligação Iônica: Se o átomo formar um cátion, o raio atômico irá diminuir, pois perdendo um ou mais elétrons o núcleo atrairá mais intensamente os elétrons. Agora, se formar um ânion, ou seja, ganhar elétrons, o raio do átomo irá aumentar, pois a carga total da eletrosfera irá ficar maior que a carga total do núcleo, diminuindo sua atração. Quanto mais elétrons ganhar, ou perder, maior será também a variação do tamanho do raio.
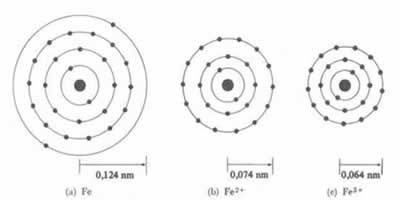
O diâmetro ou raio do cátion é sempre menor que o diâmetro ou raio do átomo
Além disso, numa série de íons isoeletrônicos, que possuem a mesma quantidade de elétrons e de níveis de energia, terá maior raio o íon que tiver menor número atômico. Por exemplo, os íons 13Al3+, 12Mg2+, 11Na1+, 9F-1, 8O2- e 7N-3, todos possuem 10 elétrons e 2 níveis eletrônicos. Mas, o que possui maior raio é o 7N-3, porque ele possui o menor número atômico (Z= 7).
*Ligação Covalente: Quando dois átomos realizam uma ligação covalente, se os dois átomos forem iguais, como no caso do gás hidrogênio (H2), pode-se falar em um raio covalente (r), que é a metade do comprimento da ligação (d), isto é, metade da distância que separa os dois núcleos. Porém, se a ligação for feita por átomos diferentes, como no caso do cloreto de hidrogênio (HCl), o comprimento ou distância (d) será a soma dos raios covalentes (r1 + r2) dos átomos envolvidos na covalência.
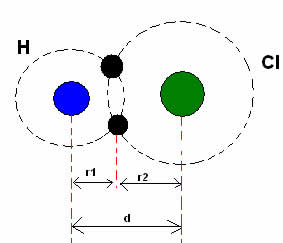
Soma dos raio atômicos em uma ligação covalente.
É claro que devemos lembrar que esta questão é muito mais complicada, pois o raio covalente de um átomo pode variar conforme ele venha a se ligar com outros átomos diferentes.
Por Jennifer Fogaça
Graduada em Química
