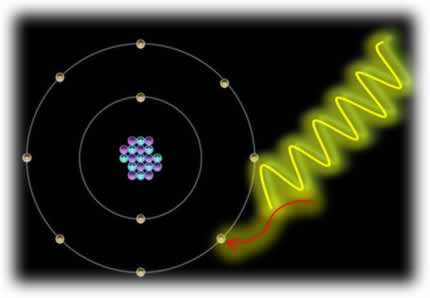
O elemento flúor, por exemplo, tem essa capacidade de atrair elétrons e “capturá-los”, originando um íon de carga negativa. Quando isso ocorre, é liberada uma quantidade de energia específica para cada elemento. No caso do flúor, essa energia é de 328 kJ. Desse modo, essa energia liberada é definida como Eletroafinidade, pois mede o grau de afinidade ou a potência da atração do átomo pelo elétron adicionado.
F (g) + e- → F-(g) + 328 kJ
Se compararmos a eletroafinidade do flúor, que é um elemento da família VII A ou 17 da Tabela Periódica, com a do lítio, pertencente à primeira família, veremos que a eletroafinidade do flúor é bem maior, pois, como vimos, é de 328 kJ, enquanto a do lítio é de apenas 60 kJ.
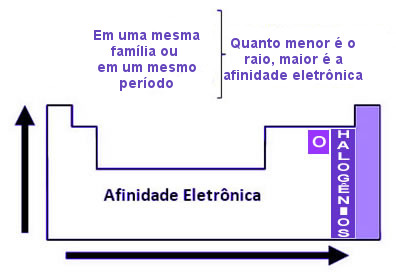
Fatos como esse se repetem ao examinarmos as eletroafinidades dos elementos ao longo dos períodos e das famílias da Tabela Periódica. Assim, apesar de não se ter ainda determinado experimentalmente os valores das eletroafinidades de todos os elementos, é possível generalizar que a eletroafinidade diminui com o aumento do raio atômico, isto é, na Tabela Periódica, ela aumenta de baixo para cima e da esquerda para a direita. O que faz da eletroafinidade uma propriedade periódica.
Portanto, como se pode observar no esquema a seguir, visto que ainda não foram determinados experimentalmente os valores das eletroafinidades dos gases nobres (família 18, ou VIII A ou ainda, 0), eles foram apenas estimadas; os elementos com maiores eletroafinidades são os halogênios (elementos pertencentes à família 17 ou VII A) e o oxigênio.
Por Jennifer Fogaça
Graduada em Química