Eletropositividade é uma propriedade que indica a tendência que um átomo tem a perder elétrons, tornando-se cátion. A eletropositividade apresenta um padrão dentro da Tabela Periódica e, por causa disso, é uma propriedade periódica. Dentro da tabela, a eletropositividade cresce em direção ao elemento químico frâncio (Fr). A eletropositividade é uma propriedade oposta à eletronegatividade, de modo que quanto maior a eletropositividade, menor a eletronegatividade. Átomos muito eletropositivos são muito reativos, com a característica de perderem elétrons com muita facilidade em reações químicas.
Leia também: Como encontrar a eletronegatividade de um elemento?
Tópicos deste artigo
- 1 - Resumo sobre eletropositividade
- 2 - Videoaula sobre eletropositividade
- 3 - O que é eletropositividade?
- 4 - Características da eletropositividade
- 5 - Como saber se um elemento é eletropositivo?
- 6 - Como a eletropositividade varia na Tabela Periódica?
- 7 - Diferenças entre eletropositividade e eletronegatividade
- 8 - Tabela de eletropositividade
- 9 - Exercícios resolvidos sobre eletropositividade
Resumo sobre eletropositividade
- Eletropositividade é uma propriedade que indica a tendência de um átomo a perder elétrons, tornando-se um cátion.
- Átomos muito eletropositivos têm grande tendência a perder elétrons em processos químicos.
- A eletropositividade é uma propriedade periódica que cresce em direção ao elemento químico frâncio (Fr).
- Eletropositividade é o oposto da eletronegatividade, ou seja, quanto maior a eletropositividade, menor a eletronegatividade.
Videoaula sobre eletropositividade
O que é eletropositividade?
A eletropositividade é uma propriedade dos átomos que indica a tendência dos elementos de perderem elétrons e se tornarem cátions. Assim, quanto mais eletropositivo for um elemento químico, maior a sua facilidade de perder elétrons. A eletropositividade é também uma propriedade periódica, apresentando um padrão de crescimento nos grupos e períodos da Tabela Periódica.
Características da eletropositividade
A eletropositividade demonstra uma tendência que um elemento tem de perder elétrons para se tornar um cátion (um íon positivo). Sendo assim, espera-se que, quanto mais eletropositivo seja o elemento, menor seja a sua energia de ionização (a energia necessária para se retirar um elétron da camada de valência).
Quando se estabelece uma ligação química, os elementos eletropositivos tendem a adquirir carga positiva (no caso de ligações iônicas) ou permanecerem em regiões deficitárias de elétrons (no caso de ligações covalentes).
O conceito de eletropositividade pode ser utilizado para entender o comportamento de um elemento em uma reação química. De maneira geral, elementos eletropositivos, uma vez que apresentam baixa densidade eletrônica ou são cátions, são mais suscetíveis a ataques nucleofílicos, atuando como bases de Lewis (aceptores de par de elétrons) em processos reacionais.
Pode-se entender a eletropositividade como o oposto da eletronegatividade, que é a tendência que um átomo tem de se tornar um ânion (um íon negativo). Contudo, não existe uma expressão matemática que entregue valores de eletropositividade como existe para a eletronegatividade. Assim sendo, os químicos tomam como parâmetro a ideia de que se um elemento é muito eletronegativo, logo ele é pouco eletropositivo, e vice-versa.
Veja também: Distribuição eletrônica — como é feita?
Como saber se um elemento é eletropositivo?
Embora não exista uma escala numérica de eletropositividade, ou seja, valores adquiridos por meio de uma expressão matemática, pode-se observar a eletropositividade de um determinado elemento a partir de sua eletronegatividade, que já tem valores estabelecidos. Assim sendo, quanto maior a eletronegatividade, menor a eletropositividade, e vice-versa.
Por isso, os metais, como são pouco eletronegativos, são os elementos mais eletropositivos. Já os ametais, que costumam ter maiores valores de eletronegatividade, são elementos pouco eletropositivos de maneira geral.
Como a eletropositividade varia na Tabela Periódica?
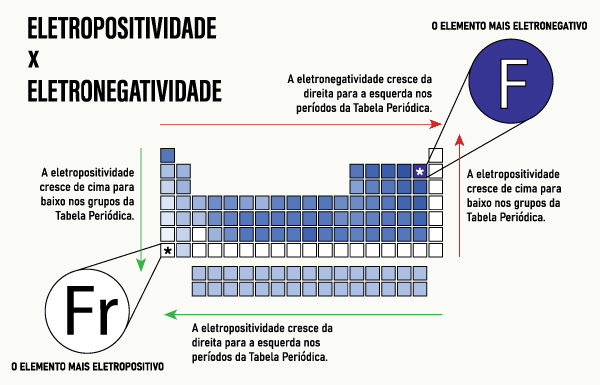
Sendo uma propriedade periódica, a eletropositividade apresenta um padrão de comportamento tanto nos grupos quanto nos períodos da Tabela Periódica. No caso, aproveita-se que ela é conceituada de forma oposta à eletronegatividade. Desse modo, como a eletronegatividade cresce em direção ao flúor (F), ou seja, de baixo para cima e da esquerda para a direita, a eletropositividade cresce em direção ao frâncio (Fr), ou seja, de cima para baixo e da direita para a esquerda.
Diferenças entre eletropositividade e eletronegatividade
Eletropositividade e eletronegatividade são conceitos opostos:
- a eletronegatividade mede a capacidade de um átomo de se tornar ânion;
- a eletropositividade mede a capacidade de um átomo de se tornar cátion.
Em termos de compostos covalentes, quanto mais eletronegativo for o elemento, mais ele atrai a densidade eletrônica da ligação para si. Dessa forma, quanto mais eletropositivo for o elemento, mais a densidade eletrônica se afasta dele em uma ligação covalente. Assim sendo, elementos eletropositivos se mantêm em regiões deficitárias de elétrons, enquanto os elementos eletronegativos buscam ficar em regiões de alta densidade eletrônica.
Contudo, eletronegatividade e eletropositividade guardam uma semelhança: quanto maior a eletronegatividade ou a eletropositividade, mais reativo é o elemento. Assim, elementos que estão no extremo da escala de eletronegatividade (que varia de 0 a 4 na escala de Pauling) são muito reativos.
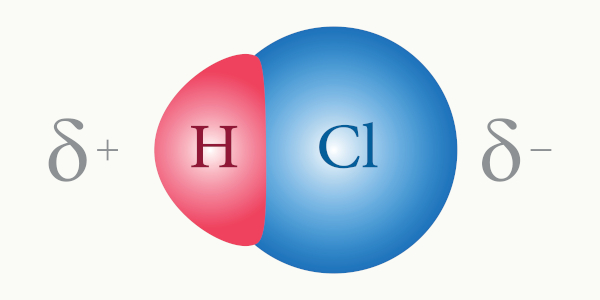
Observe a imagem abaixo:

Na molécula de água, o oxigênio é o elemento mais eletronegativo, enquanto os hidrogênios são os elementos mais eletropositivos. Isso explica a alta densidade eletrônica próxima ao oxigênio, enquanto os átomos de hidrogênio estão em uma região de baixa densidade eletrônica na molécula.
Tabela de eletropositividade
Diferentemente da eletronegatividade, não existem valores específicos de eletropositividade disponíveis na literatura, isso porque é possível inferir a eletropositividade de um elemento por meio da sua eletronegatividade (já que são propriedades opostas).
Contudo, é possível observar, indiretamente, a eletropositividade de um elemento metálico por meio dos seus potenciais-padrão de redução (processo eletroquímico de aquisição de elétrons). A eletropositividade não é igual ao potencial-padrão de redução, obviamente, pois essa propriedade está muito mais relacionada à reatividade do elemento. Porém, como elementos muito eletropositivos são também muito reativos e elementos pouco eletropositivos são pouco reativos, é possível correlacionar as duas propriedades.
Se o potencial-padrão de redução for muito baixo (muito negativo), isso quer dizer que a tendência de redução também é muito baixa. Com isso, também é possível concluir que os metais alcalinos e alcalino-terrosos são os mais eletropositivos. Os metais nobres, como prata, ouro e os do grupo da platina, entretanto, são menos eletropositivos, uma vez que apresentam baixa tendência a se tornarem cátions.
|
Metal, Mn+/M |
Potencial-padrão de redução (V) |
|
Lítio, Li+/Li |
−3,04 |
|
Césio, Cs+/Cs |
−3,03 |
|
Rubídio, Rb+/Rb |
−2,98 |
|
Potássio, K+/K |
−2,93 |
|
Bário, Ba2+/Ba |
−2,91 |
|
Estrôncio, Sr2+/Sr |
−2,90 |
|
Cálcio, Ca2+/Ca |
−2,87 |
|
Rádio, Ra2+/Ra |
−2,80 |
|
Sódio, Na+/Na |
−2,71 |
|
Magnésio, Mg2+/Mg |
−2,37 |
|
Berílio, Be2+/Br |
−1,85 |
|
Alumínio, Al3+/Al |
−1,66 |
|
Zinco, Zn2+/Zn |
−0,76 |
|
Ferro, Fe2+/Fe |
−0,45 |
|
Cádmio, Cd2+/Cd |
−0,40 |
|
Cobalto, Co2+/Co |
−0,28 |
|
Níquel, Ni2+/Ni |
−0,26 |
|
Chumbo, Pb2+/Pb |
−0,13 |
|
Cobre, Cu2+/Cu |
+0,34 |
|
Rutênio, Ru2+/Ru |
+0,45 |
|
Ródio, Rh2+/Rh |
+0,60 |
|
Prata, Ag+/Ag |
+0,80 |
|
Mercúrio, Hg2+/Hg |
+0,85 |
|
Paládio, Pd2+/Pd |
+0,95 |
|
Irídio, Ir3+/Ir |
+1,16 |
|
Platina, Pt2+/Pt |
+1,18 |
|
Ouro, Au3+/Au |
+1,50 |
|
Ouro, Au+/Au |
+1,70 |
Por meio dessa tabela, pode-se afirmar que os metais alcalinos e alcalino-terrosos, figuram entre os elementos mais eletropositivos, enquanto ouro, platina, irídio e paládio são os elementos menos eletropositivos entre os metais.
De fato, isso coincide com as leituras de eletronegatividade (escala de Pauling), em que os metais alcalinos possuem valores de eletronegatividade entre 0,7 e 1,0. Enquanto isso, o ouro possui a maior eletronegatividade entre os metais (2,4), seguido por platina, irídio e paládio (com 2,2, como os demais metais do grupo da platina, rutênio, ródio e ósmio).
O frâncio (Fr) é um elemento radioativo, instável e de difícil obtenção. Por isso, não se apresentam valores para esse metal alcalino.
Saiba mais: Quais são as famílias da Tabela Periódica?
Exercícios resolvidos sobre eletropositividade
Questão 1. (UFRGS – 3ºdia/2020) Descobertas por Gustav Rose, em 1839, as perovskitas representam uma classe de materiais com características únicas que hoje estão revelando inúmeras e versáteis aplicações em uma ampla gama de dispositivos tecnológicos.
Um tipo de perovskita muito utilizado em células solares é a baseada em haletos orgânico-inorgânicos, cuja fórmula geral é ABX3, em que A e B são cátions e X é um íon haleto. O cátion A é orgânico, maior e mais eletropositivo que o cátion B, que é tipicamente um íon metálico bivalente.
Um exemplo desse tipo de material é
a) CaTiO3.
b) (CH3NH3)PbI3.
c) (CH3NH3)FeO3.
d) (CH3COO)SnBr3.
e) CsPbCl3.
Resposta: Letra B
Das substâncias apresentadas, os das alternativas A e E não possuem um cátion orgânico. Já na alternativa C, o elemento final (X, da fórmula geral ABX3) não é um íon haleto (oxigênio é um calcogênio). Por fim, restam as alternativas B e D. Porém, a substância da alternativa D apresenta o íon orgânico CH3COO−, etanoato, o qual não é eletropositivo, dada a presença da carga negativa no átomo de oxigênio.
Questão 2. (UFRR/2019) Considere a reação de neutralização total entre:
- oxiácido formado pelo calcogênio do 3° período no seu maior estado de oxidação;
- hidróxido composto pelo metal mais eletropositivo com 3 níveis eletrônicos.
A fórmula química e a respectiva nomenclatura do composto formado são:
a) NaSO3 – sulfeto de sódio.
b) NaS – sulfeto de sódio.
c) Na2SO4 – sulfato de sódio.
d) Al2(SO4)3 – sulfito de alumínio.
e) Al2S3 – sulfato de alumínio.
Resposta: Letra C.
O calcogênio do terceiro período é o enxofre, sendo que seu maior estado de oxidação é +6. Assim, o oxiácido é o SO3. Os metais com 3 níveis eletrônicos são os do terceiro período da Tabela Periódica. Desses, o mais eletropositivo é o sódio, pois os metais alcalinos são os mais eletropositivos, já que essa propriedade atinge o máximo, no mesmo período, justamente nos metais alcalinos. Assim, trata-se do NaOH.
A referida reação é: 2 NaOH + SO3 → Na2SO4 + H2O.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. Glossary of terms used in physical organic chemistry. Pure and Applied Chemistry, Reino Unido, 1994.
HAYNES, W. M. (ed.) CRC Handbook of Chemistry and Physics. 95a ed. CRC Press: 2014.



