A classificação periódica dos elementos químicos é a forma como eles são organizados na Tabela Periódica, respeitando a ordem crescente de número atômico (Z). Esse critério é adotado em razão da lei da periodicidade proposta por Henry Moseley, que afirma que as propriedades dos elementos químicos variam de forma regular, de acordo com a quantidade de prótons.
Os elementos são organizados em grupos e períodos, de acordo com suas configurações eletrônicas, as quais justificam as propriedades físicas e químicas dos elementos, como o seu caráter metálico ou não metálico.
Veja também: O que são propriedades periódicas?
Tópicos deste artigo
- 1 - Resumo sobre a classificação periódica dos elementos químicos
- 2 - O que é classificação periódica?
- 3 - Como é feita a classificação dos elementos químicos na Tabela Periódica?
- 4 - Classificação dos elementos químicos na Tabela Periódica
- 5 - Exercícios resolvidos sobre classificação periódica dos elementos químicos
Resumo sobre a classificação periódica dos elementos químicos
-
A classificação periódica dos elementos é a forma de organização dos elementos químicos na Tabela Periódica.
-
A classificação periódica dos elementos é definida em sentido crescente do número atômico (Z).
-
Henry Moseley encontrou a relação regular entre número atômico e propriedades físico-químicas e enunciou a lei de periodicidade.
-
Os elementos são classificados de acordo com as suas características em metais e não metais.
Não pare agora... Tem mais depois da publicidade ;) -
Também podem ser classificados de acordo com a configuração eletrônica, em elementos representativos e elementos de transição.
O que é classificação periódica?
A classificação periódica é o agrupamento dos elementos químicos adotando como critério suas características em comum.
Cada elemento possui propriedades próprias. No entanto, algumas dessas propriedades são compartilhadas com outros elementos químicos. Com base nisso, os cientistas agruparam os elementos químicos conhecidos em grupos ou famílias, junto a outros elementos com propriedades químicas semelhantes.
A classificação periódica dos elementos é feita com base em suas propriedades, assim como é possível organizar objetos utilizando algum critério de seleção, como cores ou formato. A formação desses grupos levou à construção da Tabela Periódica.
Em torno de 1800, eram conhecidos apenas 31 elementos químicos. Com o passar do tempo, outros elementos foram descobertos. Atualmente, a Tabela Periódica é composta por 118 elementos. À medida que o número de elementos químicos aumentou, tornou-se então necessário criar um mecanismo de classificação.
A classificação dos elementos traz vantagens ao usar a Tabela Periódica como ferramenta de estudo. Em razão da organização periódica é possível:
-
entender melhor as propriedades dos elementos e de seus compostos;
-
tornar mais simples a comparação e a diferenciação dos elementos químicos, conhecendo as características de seu grupo;
-
prever as propriedades do elemento e dos compostos derivados, de acordo com a sua posição na Tabela Periódica.
Como é feita a classificação dos elementos químicos na Tabela Periódica?
A classificação dos elementos químicos é construída no sentido crescente de seus números atômicos (Z).
Em 1913, o cientista britânico Henry Moseley enunciou a lei da periodicidade, em que afirmava que as propriedades dos elementos são uma função periódica de seu número atômico. Moseley, com base em seus experimentos, notou que muitas propriedades químicas e físicas dos elementos se repetiam em intervalos regulares, que correspondiam às unidades de prótons contidas no núcleo dos átomos, ou seja, seu número atômico.

A partir disso, a Tabela Periódica foi reorganizada e passou a ser orientada pelos valores de número atômico, e não mais de massa atômica. Com a evolução da área da Química ao passar do tempo, ficou clara a correlação entres as propriedades observáveis de cada elemento e sua configuração eletrônica.
Assim, os elementos químicos de um mesmo grupo ou família (linhas verticais ou colunas) compartilham características em comum, em razão de possuírem o mesmo número de elétrons na camada de valência.
Ao mesmo tempo, os elementos localizados em um período da Tabela Periódica (linha horizontal) possuem o mesmo número de camadas eletrônicas ocupadas.
Saiba mais: Qual é a origem da Tabela Periódica?
Classificação dos elementos químicos na Tabela Periódica
Existem duas formas de classificação dos elementos químicos da Tabela Periódica.
→ Classificação dos elementos químicos — natureza e características
Os elementos químicos podem ser agrupados na Tabela Periódica de acordo com a sua natureza e as suas características, sendo classificados como metais e não metais.
◦ Metais
Os metais correspondem a cerca de 78% dos elementos da Tabela Periódica e estão todos localizados do lado esquerdo da tabela.
As características gerais dos metais são:
-
serem sólidos em temperatura ambiente, com exceção do mercúrio (líquido);
-
terem elevados pontos de fusão e de ebulição;
-
terem brilho metálico característico;
-
serem maleáveis;
-
serem bons condutores térmicos e elétricos;
Não pare agora... Tem mais depois da publicidade ;) -
possuírem tendência em formar cátions.
◦ Não metais ou ametais
Os ametais são elementos não metálicos e são minoria na Tabela Periódica. Eles incluem os halogênios (grupo 17) e os gases nobres (grupo 18). Estão localizados no lado superior direito.
As características gerais dos não metais são praticamente opostas às características dos metais, sendo as principais delas:
-
serem sólidos ou gases em temperatura ambiente, com exceção do bromo (líquido);
-
quando sólidos, serem quebradiços;
-
terem baixos pontos de fusão e de ebulição;
Não pare agora... Tem mais depois da publicidade ;) -
serem maus condutores térmicos e elétricos (isolantes);
-
possuírem tendência em formar ânions.
Os gases nobres constituem um grupo singular de elementos químicos em razão de suas propriedades únicas. São encontrados na natureza de forma estável e isolada, pois não possuem tendência em formar compostos com outros elementos espontaneamente.
◦ Semimetais
Os semimetais ou metaloides eram uma classe de elementos químicos que englobava alguns elementos cujas características eram intermediárias entre os metais e os não metais, tais como:
-
possuir brilho metálico;
-
serem sólidos quebradiços;
Não pare agora... Tem mais depois da publicidade ;) -
poderem formar cátions ou ânions;
-
serem semicondutores, ou seja, possuírem característica condutora ou isolante, dependendo da circunstância.
A classificação de semimetais ou metaloides deixou de ser adotada pela Iupac (International Union of Pure and Applied Chemistry), no entanto alguns materiais didáticos e Tabelas Periódicas ainda adotam essa nomenclatura. Tais elementos semimetálicos estão localizados na tabela em sequência diagonal na fronteira entre os elementos metálicos (à esquerda) e os não metálicos (à direita).
Nas Tabelas Periódicas atualizadas, os elementos germânio, antimônio e polônio são classificados como metais e os elementos boro, silício, arsênio e telúrio, como pertencentes ao grupo dos ametais.
A imagem a seguir representa a Tabela Periódica cujas cores se referem à classificação dos elementos de acordo com as suas características físicas e químicas. Note que nesta versão da Tabela Periódica ainda são apresentados os elementos semimetálicos, mas se atente à observação realizada anteriormente sobre essa classe de elementos.
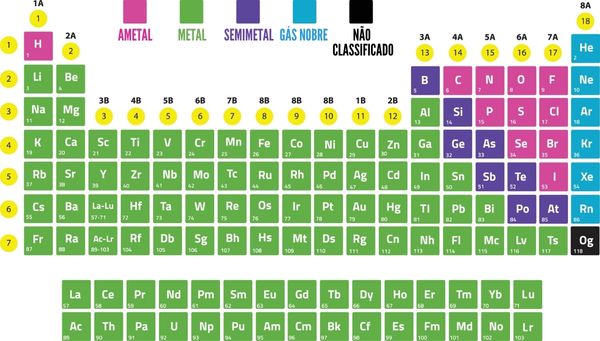
Importante: Embora o hidrogênio esteja classificado na imagem apresentada como ametal, é importante lembrar que esse elemento é único na Tabela Periódica e não possui propriedades similares nem às dos metais e nem às dos ametais.
→ Classificação dos elementos químicos — configuração eletrônica
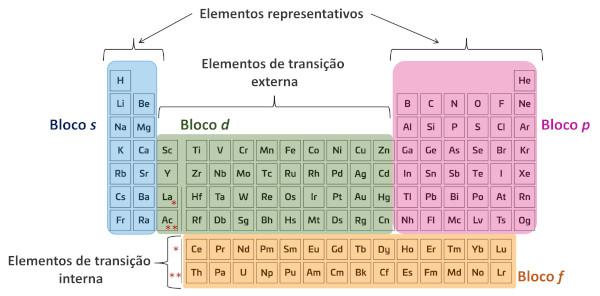
Outra forma de classificar os elementos químicos é segundo a sua configuração eletrônica, ou seja, os elementos são classificados em função da subcamada de maior energia que está ocupada por elétrons. Nesse caso, são divididos em quatro blocos (s, p, d, f) ou como elementos representativos e de transição.
◦ Elementos representativos
Os elementos representativos são aqueles distribuídos entre os blocos s e p da Tabela Periódica.
-
Bloco s
O bloco s é formado pelas duas colunas esquerdas da Tabela Periódica (grupos 1 e 2). Os elementos desse bloco possuem seus elétrons de valência na subcamada s da camada de energia mais externa. Como a subcamada s pode acomodar apenas dois elétrons, o bloco s compreende apenas dois grupos.
Os elementos do grupo 1 possuem configuração eletrônica ns1 e são conhecidos como metais alcalinos. Os elementos do grupo 2 têm configuração eletrônica ns2 e são conhecidos como metais alcalinoterrosos. Os elementos hidrogênio e hélio também fazem parte do bloco s. A configuração eletrônica geral para os elementos do bloco s é ns1-2.
Importante: O fator n se refere à camada eletrônica ocupada e pode variar de 1 a 7.
-
Bloco p
O bloco p é formado por elementos que possuem seus elétrons de valência em subcamadas p da camada mais externa. A subcamada p é capaz de acomodar até seis elétrons, por isso o bloco p é formado por seis grupos da Tabela Periódica (grupos 13 a 18).
A configuração eletrônica geral para os elementos do bloco p é ns2 np1-6, sendo n = 2 - 7.
◦ Elementos de transição
Os elementos de transição são aqueles distribuídos entre os blocos d e f da Tabela Periódica.
-
Bloco d
O bloco d é formado pelos elementos que possuem seu elétron mais energético ocupando a subcamada d do penúltimo nível eletrônico (camada).
A subcamada d é capaz de acomodar até dez elétrons, por isso o bloco d é formado por dez grupos da Tabela Periódica (grupos 3 a 12).
A configuração eletrônica geral para os elementos do bloco d é (n-1)d1-10 ns0-2, sendo n = 4 - 7.
Os elementos do bloco d também são conhecidos como elementos de transição externa.
-
Bloco f
O bloco f reúne os elementos químicos que possuem elétrons de valência nas subcamadas f do penúltimo nível eletrônico.
Esses elementos são classificados em duas séries diferentes, a depender no nível eletrônico. Os elementos que possuem seus elétrons de valência na camada 4f pertencem à série dos lantanídeos, e aqueles que possuem a subcamada 5f como mais energética pertencem à série dos actinídeos.
A configuração eletrônica geral para os elementos do bloco f é (n-2)f1-14 (n-1)d0-2 ns2, sendo n = 6 - 7.
Os elementos do bloco f também são conhecidos como elementos de transição interna, pois na versão padrão da Tabela Periódica eles são apresentados como um bloco abaixo dela, mas na realidade estão incluídos nos intervalos de número atômico entre 57 a 71 (lantanídeos) e 89 a 103 (actinídeos).
Leia também: Quais são os nomes dos novos elementos químicos?
Exercícios resolvidos sobre classificação periódica dos elementos químicos
Questão 1
(UFPR — adaptado) A respeito da classificação dos elementos químicos na Tabela Periódica, analise as afirmativas:
I. O fato de os elementos de um mesmo grupo apresentarem o mesmo número de elétrons na camada de valência não faz com que suas propriedades físico-químicas sejam semelhantes.
II. Os elementos pertencentes a um mesmo período estão dispostos, na Tabela Periódica atual, em ordem crescente de número atômico.
III. Todos os elementos que possuem configuração eletrônica igual a ns1 na camada de valência pertencem ao grupo 1.
IV. Todos os elementos que possuem configuração eletrônica igual a ns2 np1-6 na camada de valência pertencem ao bloco s.
V. No final de cada período, localizam-se elementos que possuem baixa tendência à reatividade química.
Está correto o que se afirma em:
A) I, II e III.
B) II, III e V.
C) III, IV e V.
D) II e III.
E) I, II e IV.
Resolução:
Alternativa B
A afirmativa I é incorreta, pois os elementos de um grupo apresentam o mesmo número de elétrons na camada de valência, e exatamente por isso suas propriedades físico-químicas são semelhantes.
A afirmativa II é correta, pois a ordenação dos elementos na Tabela Periódica se dá em ordem crescente de número atômico.
A afirmativa III é correta. Todos os elementos que possuem configuração eletrônica igual a ns1 na camada de valência estão localizados no grupo 1.
A afirmativa IV é incorreta. Todos os elementos que possuem configuração eletrônica igual a ns2 np1-6 na camada de valência pertencem ao bloco p.
A afirmativa V é correta. Ao final de cada período, estão localizados os gases nobres, que são elementos com baixa tendência à reatividade.
Questão 2
(FEI-SP) Baseando-se nas configurações eletrônicas em ordem crescente de energia dos elementos a seguir, identifique a alternativa correta.
A - 1s2 2s2 2p6 3s2 3p6 4s2
B - 1s2 2s2 2p6 3s2 3p6 4s2 3d2
C - 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2
D - 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f2
A) C e D estão no mesmo período da Tabela Periódica.
B) A e C pertencem ao mesmo grupo, mas estão em períodos diferentes.
C) A, B, C, D são todos metais alcalinoterrosos.
D) A não é um bom condutor de calor e de eletricidade.
E) D é um elemento de transição.
Resolução:
Alternativa E
O item A está incorreto, pois o elemento C está no período 4 e o elemento D está no período 6.
O item B está incorreto. Os elementos A e C não pertencem ao mesmo grupo, pois estão em blocos diferentes. O elemento A (configuração eletrônica terminada em 4s2) está no bloco s. O elemento B (configuração eletrônica terminada em 3d2) está no bloco d (elemento de transição).
O item C está incorreto. A configuração eletrônica de um metal alcalinoterroso (grupo 2) é ns2. Portanto, apenas o elemento A pode ser pertencer a esse grupo.
O item D está incorreto. O elemento A possui configuração eletrônica terminada em 4s2, logo está no grupo 2, localizado à esquerda da tabela. Os elementos à esquerda são metálicos, e as características descritas são de não metais.
O item E está correto. Os elementos de transição são aqueles que possuem as subcamadas d e f ocupadas pelos elétrons de valência.
Por Ana Luiza Lorenzen Lima
Professora de Química



