A história da Tabela Periódica começou com o químico russo Dmitri Mendeleev, no ano de 1869. Sua forma de organização dos elementos foi amplamente aceita, não só por contestar pesos atômicos da época, mas também porque previa a existência de elementos ainda não descobertos. Na sua tabela, as propriedades químicas apresentam periodicidade, ou seja, repetem-se depois de um certo número de elementos.
A Tabela Periódica não é algo que se estagnou com o tempo. Mesmo após sua concepção ela já recebeu diversas mudanças, sendo a principal no começo do século XX, quando Henry Moseley reorganizou a tabela em ordem crescente de número atômico. Até a concepção da Tabela Periódica, diversas foram as tentativas de organização dos elementos. A ONU, em homenagem aos 150 anos da criação da Tabela Periódica, determinou o ano de 2019 como o Ano Internacional da Tabela Periódica.
Leia também: Quais são os elementos químicos?
Tópicos deste artigo
- 1 - Resumo sobre a história da Tabela Periódica
- 2 - Mapa mental sobre a história da Tabela Periódica
- 3 - Quem criou a Tabela Periódica?
- 4 - Evolução da Tabela Periódica
- 5 - Por que a Tabela Periódica recebe esse nome?
- 6 - Linha do tempo da Tabela Periódica
- 7 - Tabela Periódica completa e atualizada
- 8 - Importância da Tabela Periódica
- 9 - Exercícios resolvidos sobre a história da Tabela Periódica
Resumo sobre a história da Tabela Periódica
- A Tabela Periódica foi criada pelo russo Dmitri Mendeleev, em março de 1869.
- A Tabela de Mendeleev contava inicialmente com 63 elementos e, de lá para cá, sofreu diversas alterações, sendo a mais significativa a reorganização em termos de números atômicos, por meio dos trabalhos de Henry Moseley na década de 1910.
- A Tabela Periódica recebe esse nome por conta da periodicidade das propriedades dos elementos, ou seja, elas se repetem depois de um intervalo de elementos.
- Apesar de a tabela ter sido criada em 1869, diversas foram as tentativas no século XIX em criar uma forma racional para organizar os elementos.
- A Tabela Periódica, atualmente, é controlada pela entidade máxima da Química, a Iupac.
Mapa mental sobre a história da Tabela Periódica
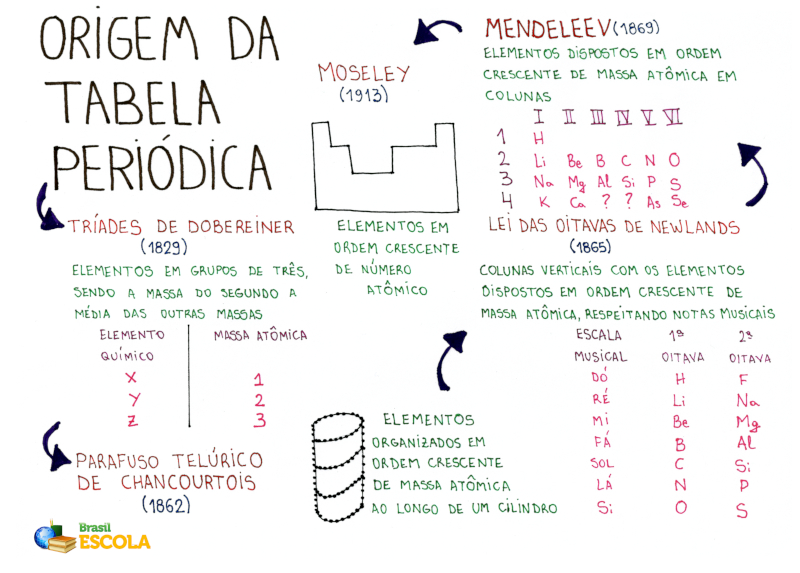
* Baixe o mapa mental sobre origem da tabela periódica!
Quem criou a Tabela Periódica?
A Tabela Periódica foi desenvolvida pelo químico russo Dmitri Mendeleev no ano de 1869, mais especificamente no dia 1º de março. À altura, a tabela alocava apenas 63 elementos químicos.
Evolução da Tabela Periódica
Inicialmente a Tabela Periódica continha apenas 63 elementos químicos, descobertos até a data da sua concepção por Mendeleev. Entretanto, a versão original pouco se parece com a que conhecemos atualmente, que já consta com 118 elementos químicos. Isso nos faz perceber que a Tabela Periódica não ficou estagnada, estando em constante revisão e estudo.
O próprio Mendeleev chegou a adicionar um oitavo grupo, chamado por ele de transição, por causa de uma quebra na periodicidade das propriedades dos elementos, a partir do elemento químico ferro, quando eles eram organizados por meio do seu peso atômico. Posteriormente, os elementos desse oitavo grupo foram definitivamente incorporados à tabela.
No fim do século XIX a Tabela Periódica passou por outra evolução, ao incluir os gases nobres, descobertos, em sua grande maioria, por William Ramsay. A Tabela Periódica começou a ter uma cara mais próxima da que conhecemos atualmente por meio dos trabalhos de Alfred Werner, ao incluir uma série de transição, o que hoje entendemos como o bloco d da tabela.
Vale lembrar, ainda, que a Tabela Periódica foi concebida em uma época em que a estrutura atômica e os elétrons eram desconhecidos. É por isso que Mendeleev organizou os elementos em ordem crescente dos seus pesos atômicos. Dessa forma, a principal evolução foi feita seis anos após a morte de Mendeleev, em 1913, quando Henry Moseley reorganizou a Tabela Periódica em ordem crescente de números atômicos, substituindo a organização original por massas atômicas.

Por que a Tabela Periódica recebe esse nome?
O nome “periódico” faz relação a algo que se repete, ou seja, que apresenta uma frequência. Por exemplo, se você possui aulas de Química às quartas-feiras, então ela apresenta uma periodicidade em sua vida.
Assim sendo, a Tabela Periódica organiza os elementos de uma forma que algumas propriedades físicas e químicas se repetem ao longo dela. Por exemplo, o lítio é um metal alcalino, o qual reage violentamente com a água. Essa propriedade irá se repetir na linha seguinte, no metal alcalino sódio e, posteriormente, no potássio, no rubídio e no césio.
Não à toa as linhas da Tabela Periódica são chamadas de “períodos” e, em cada uma delas, o padrão de comportamento dessas propriedades se repete novamente. Isso permite fazer projeções das propriedades, ou seja, não é necessário avaliar a tabela como um todo, mas sim o comportamento em um único período, permitindo extrapolar para todos os demais, de certa forma. Por exemplo, a energia de ionização dos elementos, que é a energia necessária para se retirar um elétron da camada de valência de um átomo, apresenta praticamente o mesmo comportamento em todos os períodos da tabela: é menor nos metais alcalinos e vai crescendo em direção aos gases nobres.
Leia também: Quais são as famílias da Tabela Periódica?
Linha do tempo da Tabela Periódica
A seguir será disposta uma linha do tempo até a concepção da Tabela Periódica de Mendeleev, com a referência aos cientistas que auxiliaram, direta ou indiretamente, na sua criação.
- 1789: Antoine Lavoisier apresenta, na sua obra “Tratado Elementar de Química”, uma lista com 33 elementos, gases, metais e não metais terrosos. É bem verdade que muitos desses elementos passaram a ser entendidos como compostos, mas 25 dos elementos apresentados ainda figuram na Tabela Periódica.
- 1817: Johann Wolfgang Döbereiner apresenta a “Lei das Tríades”. O cientista percebeu que muitos elementos podiam ser agrupados em trios (tríades) com base em suas propriedades e organizados pelo peso atômico. Nessa organização, o peso atômico do segundo membro da tríade era, aproximadamente, a média dos pesos do primeiro e do terceiro elemento da tríade.
- 1849 – Germaine Henri Ivanovitch Hess apresentou, no seu livro “Fundamentos da Química Pura”, a ideia de “família”. Hess chegou a descrever quatro grupos de não metais com propriedades químicas semelhantes.
- 1851: Jean Baptiste A. Dumas tentou explicar o trabalho de Döbereiner, estabelecendo relações numéricas entre os pesos atômicos de alguns grupos de elementos. Para ele, os pesos atômicos dos elementos de uma mesma família estariam conectados por uma relação aritmética, em que aumentavam em múltiplos de 16.
- 1860: Ocorre o Congresso de Karlsruche, que reuniu 129 químicos, entre eles Dmitri Mendeleev e Julius Lothus Meyer, os quais tiveram acesso a estudos acerca de um novo sistema de pesos atômicos, realizado por Stanislao Cannizzaro.
- 1862: Alexandre Émile Béguyer de Chancourtois desenvolveu o “Parafuso Telúrico”, uma representação tridimensional que organizava os elementos em uma hélice em ordem crescente de pesos atômicos. Assim, o cientista conseguiu perceber uma repetição periódica das propriedades dos elementos que estavam no eixo vertical do parafuso. Apesar de ter sido o primeiro a perceber uma periodicidade nas propriedades químicas, o “Parafuso Telúrico” de Chancourtois não teve a difusão esperada, muito por causa da dificuldade em representá-lo e na sua dificuldade, como geólogo, em disseminar as ideias em termos mais próximos da Química.
- 1863: John A. R. Newlands desenvolveu a chamada “Lei das Oitavas”, em que reunia os elementos a partir das suas semelhanças de propriedades em 11 grupos. Como as propriedades se repetiam a cada oito elementos, Newlands decidiu pelo nome “oitavas”, em referência às oitavas musicais. Apesar de não ter recebido o devido reconhecimento inicialmente, sendo inclusive zombado no começo, Newlands chegou a ser premiado, em 1887, com a Davy Medal of the Royal Society de Londres.
- 1864: William Odling organizou elementos em grupos de propriedades análogas, respeitando a ordem crescente de pesos atômicos. Isso foi considerado um precursor da Tabela Periódica.
- 1864-1870: Julius Lothus Meyer produziu tabelas para organização dos elementos. Em 1864, publicou sua primeira tabela, contendo 28 elementos organizados por suas valências (ou seja, com quantos outros átomos eles eram capazes de se combinar). Posteriormente, em 1868, Meyer trabalhou em uma Tabela Periódica que continha todos os elementos conhecidos, listados em ordem crescente de peso atômico, tendo elementos de mesma valência dispostos em linhas verticais, de forma muito semelhante à Tabela Periódica de Mendeleev. Contudo, os trabalhos de Meyer só foram publicados em 1870, no ano seguinte à divulgação dos trabalhos de Mendeleev.
- 1869: No dia 1º de março, Dmitri Mendeleev completou seu trabalho sobre “a experiência de um sistema de elementos baseado em seu peso atômico e semelhança química”. Alguns dias depois, em 18 de março, apresentou uma versão melhorada para a Sociedade Russa de Química, em São Petersburgo. A primeira tabela de Mendeleev foi publicada também nesse ano, no artigo “A Correlação de Propriedades com o Peso Atômico dos Elementos”, no jornal da Sociedade Russa de Química. A Tabela de Mendeleev não só desafiava pesos atômicos como também previa que certos elementos ainda não tinham sido descobertos.
- 1913: Henry Moseley apresentou seus estudos acerca da relação entre raios X e elementos químicos. Por meio deles, estabeleceu uma nova forma de identificar elementos químicos, ao notar que a frequência dos raios X refletidos pelos elementos aumentava com a carga nuclear e não com a massa. Moseley acabou comprovando que determinadas propriedades eram então função da carga nuclear (o número atômico) e não mais dos pesos atômicos, como imaginado por Mendeleev. Assim, a tabela foi reorganizada em ordem crescente do número atômico.
Tabela Periódica completa e atualizada
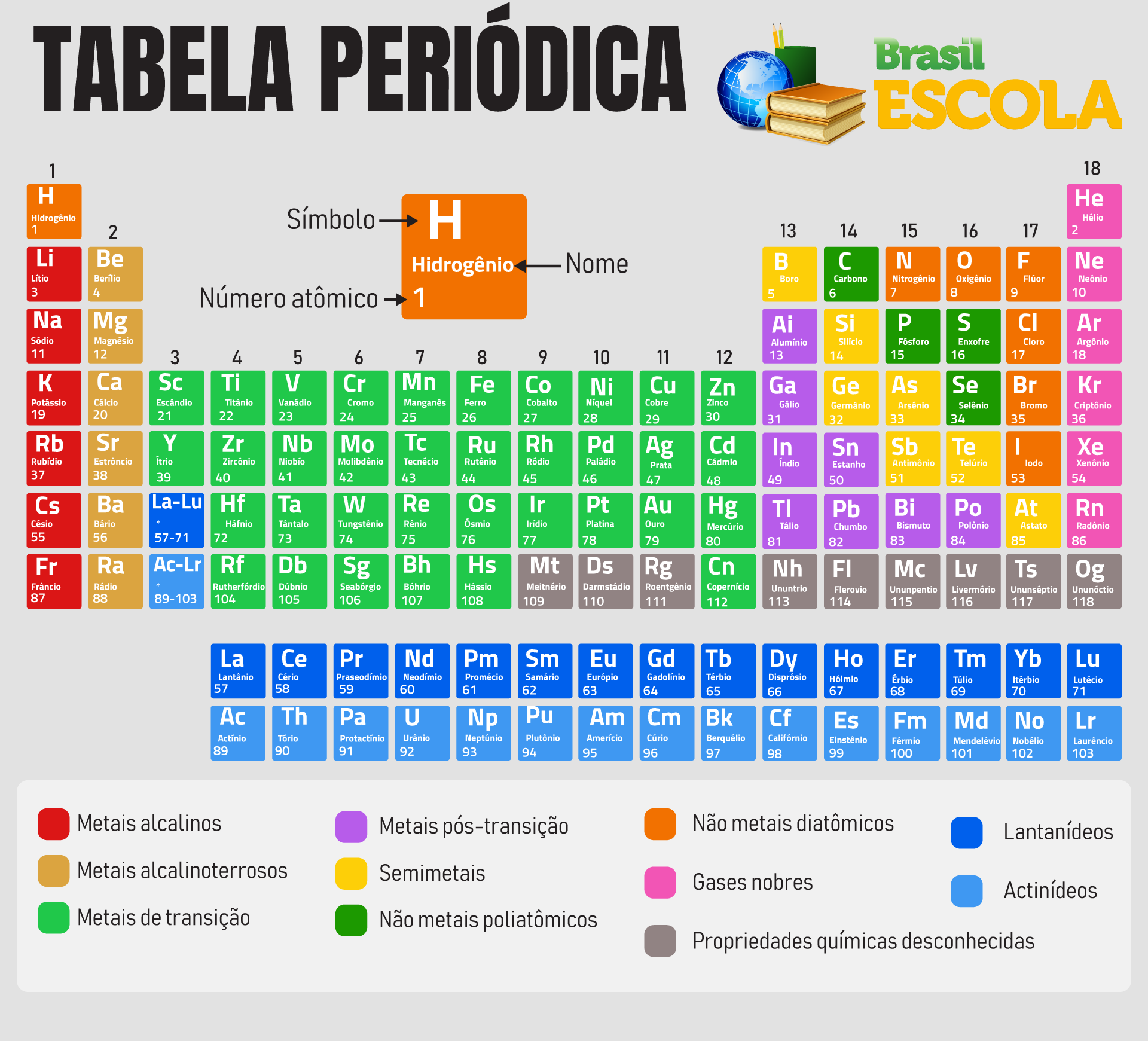
Atualmente, a Tabela Periódica é controlada pela autoridade máxima de Química existente no mundo, a União Internacional de Química Pura e Aplicada (Iupac). A última versão da tabela é datada de 4 de maio de 2022, constando os nomes, símbolos, números atômicos e massas atômicas aprovados pela entidade.
Importância da Tabela Periódica
A Tabela Periódica é um instrumento essencial para os químicos e para os aspirantes da área. Graças a ela, tem-se uma forma de organização de todos os elementos existentes, permitindo-se compreender e prever propriedades. As noções modernas da estrutura atômica permitiram unir a organização da Tabela Periódica com outros conceitos, como distribuição eletrônica e camadas de valência.
Muitas são as propriedades que podemos descobrir ou analisar pela simples utilização da Tabela Periódica, as chamadas propriedades periódicas. Não se deve limitar a tabela a um mero catálogo de elementos conhecidos, mas sim vê-la como uma janela para a compreensão do universo. Graças a ela, cientistas podem prever propriedades da matéria em qualquer ponto no nosso universo. Ela não é só importante na Química, mas também em outras áreas do conhecimento científico, como Física, Biologia e Astronomia.
A importância da Tabela Periódica é tão grande que a ONU decretou o ano de 2019 o ano internacional da Tabela Periódica, em comemoração aos 150 anos de sua concepção.
Exercícios resolvidos sobre a história da Tabela Periódica
Questão 1. (UEA Geral/2023) A pesquisa científica relacionada à organização sistemática dos elementos químicos a partir de suas propriedades físico-químicas teve início no século 19.
A Tabela Periódica no formato utilizado atualmente é o resultado do trabalho do químico de sobrenome
- Rutherford.
- Mendeleev.
- Dalton.
- Thomson.
- Bohr.
Resposta: Letra B.
A Tabela Periódica foi criada através dos trabalhos do químico russo Dmitri Mendeleev, apresentando-a em março de 1869.
Questão 2. (Uece 2ª Fase 2º Dia/2022.1) Henry Gwyn Jeffreys Moseley (1887–1915), morto em combate na Índia durante a Primeira Guerra Mundial, deu uma definitiva contribuição para elaborar uma lei de recorrência para a Classificação Periódica dos elementos ao determinar um valor para cada um deles no que diz respeito
- ao volume atômico.
- à massa atômica.
- ao número atômico.
- à eletronegatividade.
Resposta: Letra C.
Os trabalhos de Moseley, que envolveram raios X, conseguiram correlacionar a identidade dos elementos químicos com sua carga nuclear, o chamado número atômico. Esse novo sistema de identificação fez com que a Tabela Periódica fosse reorganizada em ordem crescente de números atômicos.
Créditos da imagem
Fontes:
LORENZETTI, C. S.; DAMASIO, F.; RAICIK, A. O Ano Internacional da Tabela Periódica e um sucinto resgate de sua história: implicações para a educação científica por meio da divulgação científica. Experiências em Ensino de Ciências. v. 15, n. 3, 2020.
LEITE, B. S. O Ano Internacional da Tabela Periódica e o Ensino de Química: das cartas ao digital. Química Nova. v. 42, n. 6, p. 702-710, 2019.
ROYAL SOCIETY OF CHEMISTRY. Development of the periodic table. Royal Society of Chemistry. Disponível em: <https://www.rsc.org/periodic-table/history/about>.


