Denomina-se raio iônico o tamanho de um íon. O estudo dessa propriedade é dependente do conhecimento sobre raio atômico e íons.
-
Raio atômico: é a medida do tamanho de um átomo neutro (distância teórica do núcleo até a última eletrosfera).
-
Íons: átomos que perdem (cátions) ou ganham elétrons (ânions).
Os prótons existentes no interior do núcleo de um átomo exercem uma força de atração sobre os elétrons (partículas negativas) presentes nas eletrosferas. Quanto maior for o número de prótons, maior será essa atração e vice-versa. Quando o número de elétrons de um átomo é modificado por uma perda ou ganho dessas partículas, a atração entre prótons e elétrons é modificada da seguinte forma:
No caso de um cátion:
O número de elétrons nas eletrosferas passa a ser menor que o número de prótons no interior do núcleo, o que torna a força de atração do núcleo maior, atraindo mais para perto de si os elétrons das eletrosferas. O resultado é uma diminuição do raio do átomo. Assim, o raio de um cátion será sempre menor do que o raio do seu átomo neutro.
Raio do átomo neutro > Raio do cátion
No caso de um ânion:
O número de elétrons nas eletrosferas passa a ser maior do que o número de prótons no interior do núcleo. Nesse caso, a força de atração exercida pelo núcleo é superada pela força de repulsão entre os elétrons presentes nas eletrosferas O resultado é um aumento do raio do átomo. Assim, o raio de um ânion será sempre maior do que o raio do seu átomo neutro.
Raio do ânion > Raio do átomo neutro
As duas situações apresentadas a seguir exemplificam bem o que ocorre com o raio de um íon:
1º) Átomo neutro de Sódio (11Na) e o cátion Sódio (11Na+)
Enquanto o átomo neutro de sódio apresenta onze prótons (esferas amarelas) e onze elétrons (esferas vermelhas), o cátion sódio apresenta onze prótons e dez elétrons.
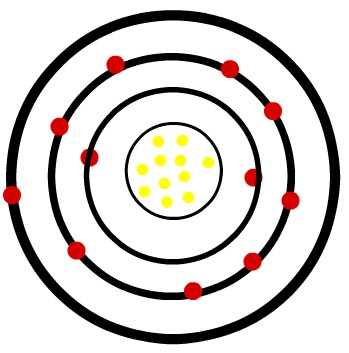
Modelo de um átomo neutro do Sódio
Quando o átomo neutro do sódio perde um elétron, o raio sofre uma diminuição.
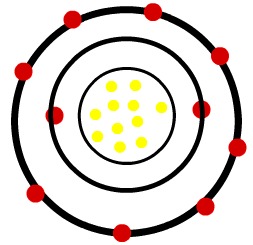
Modelo de um cátion do sódio
Observação: O terceiro nível não foi representado na imagem do cátion porque, como ele perdeu o único elétron que tinha, ficou vazio e, por isso, passou a ser desconsiderado, mas está presente.
2º) Átomo neutro de Fósforo (15P) e o cátion Fósforo (15P-3)
Enquanto o átomo neutro de fósforo apresenta quinze prótons (esferas amarelas) e quinze elétrons (esferas vermelhas), o ânion fósforo apresenta quinze prótons e dezoito elétrons.
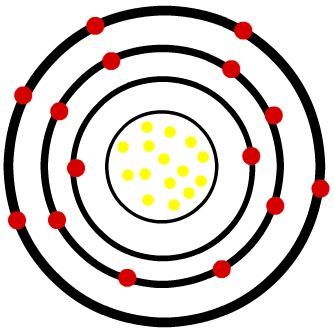
Modelo de um átomo neutro do fósforo
Quando o átomo neutro do fósforo ganha três elétrons, o raio sofre um aumento.
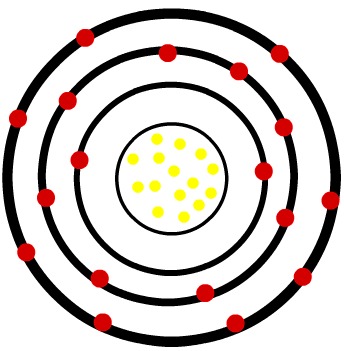
Modelo de um ânion do fósforo
Por Me. Diogo Lopes Dias