Se analisarmos a distribuição eletrônica de determinado átomo no diagrama de energia (ou diagrama de Pauling) é possível ‘prever’ duas questões referentes à localização do elemento desse átomo na Tabela Periódica: o período e a família.
Consideremos primeiramente o período:

Por exemplo, considere o caso de quatro elementos de diferentes períodos:
· Be (Z = 4): A ordem geométrica da distribuição eletrônica do berílio é: 1s2 / 2s2.
Veja que foram preenchidos 2 níveis, portanto, o berílio é do 2º período.
· Na (Z = 11): A ordem geométrica da distribuição eletrônica do sódio é: 1s2 / 2s2 2p6 / 3s1.
Nesse caso, foram preenchidos 3 níveis, portanto, o sódio é do 3º período.
· As (Z = 33): A ordem geométrica da distribuição eletrônica do arsênio é: 1s2 / 2s2 2p6 / 3s2 3p6 3d10 / 4s2 4p3.
Foram preenchidos 4 níveis, então o arsênio é do 4º período.
· I (Z = 53): A ordem geométrica da distribuição eletrônica do iodo é: 1s2 / 2s2 2p6 / 3s2 3p6 3d10 / 4s2 4p6 4d10 / 5s2 5p5.
Foram preenchidos 5 níveis, então o iodo é do 5º período.
Agora consideremos como podemos descobrir a família do elemento:

Veja como isso ocorre em cada um dos grupos de elementos mencionados acima:
· Elementos Representativos:
Esses elementos são aqueles que pertencem às famílias: 1, 2, 13, 14, 15, 16, 17 e 18. Eles também são chamados de elementos típicos ou característicos e em tabelas ainda não atualizadas eles correspondem aos elementos que estão nas colunas A (IA, IIA, IIIA, IVA, VA, VIA, VIIA, VIII A).
Sempre que o elétron mais energético estiver em um subnível s ou p, ele será um elemento representativo. Além disso, a soma dos elétrons que foram preenchidos no nível mais externo, nos mostra qual é sua respectiva família.
Veja como isso ocorre:
· Família 1: Todos possuem 1 elétron no último nível de energia.
Exemplos:
1H: 1s1 → Apesar de não ser um metal alcalino, o hidrogênio aparece na tabela na família 1, porque ele possui 1 elétron na sua última e única camada.
3Li: 1s2 / 2s1
11Na: 1s2 / 2s2 2p6 / 3s1
19K: 1s2 / 2s2 2p6 / 3s2 3p6 / 4s1
37Rb: 1s2 / 2s2 2p6 / 3s2 3p6 3d10 / 4s2 4p6 / 5s1
55Cs: 1s2 / 2s2 2p6 / 3s2 3p6 3d10 / 4s2 4p6 4d10 / 5s2 5p6 / 6s1
87Fr: 1s2 / 2s2 2p6 / 3s2 3p6 3d10 / 4s2 4p6 4d10 4f14 / 5s2 5p6 5d10 / 6s2 6p6 / 7s1
Dessa forma, podemos concluir que a configuração eletrônica dos elementos desse grupo termina com ns1 (n = 1 a 7).
Isso nos ajuda a ver que há então uma generalização para os outros grupos ou famílias:
· Família 2: Todos possuem 2 elétrons no último nível e a configuração eletrônica termina em ns2.
· Família 13: Todos possuem 3 elétrons no último nível e a configuração eletrônica termina em ns2 np1.
· Família 14: Todos possuem 4 elétrons no último nível e a configuração eletrônica termina em ns2 np2.
· Família 15: Todos possuem 5 elétrons no último nível e a configuração eletrônica termina em ns2 np3.
· Família 16: Todos possuem 6 elétrons no último nível e a configuração eletrônica termina em ns2 np4.
· Família 17: Todos possuem 7 elétrons no último nível e a configuração eletrônica termina em ns2 np5.
- Elementos de transição externa:
Os elementos de transição são os que ficam nas famílias de 3 a 12, sendo que os de transição externa são os que ficam expostos (externos). Nas tabelas antigas os elementos de transição ocupam as colunas B.
Eles possuem o elétron mais energético em um subnível d incompleto. A sua configuração eletrônica termina em ns2 (n-1)d (1 até 8).
Veja dois exemplos, cujas configurações estão agora na ordem de energia:
28Ni: 1s2 2s2 2p6 3s2 3p6 4s2 3d8
39Y: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d1
- Elementos de transição interna:
São aqueles elementos que ocupam o grupo 3 da Tabela Periódica, mas que ficam internos e, para vê-los, puxamos uma linha repetindo os períodos 6 e 7 abaixo da tabela. O período 6 é denominado de série dos lantanídios, e o 7 é a série dos actinídios.
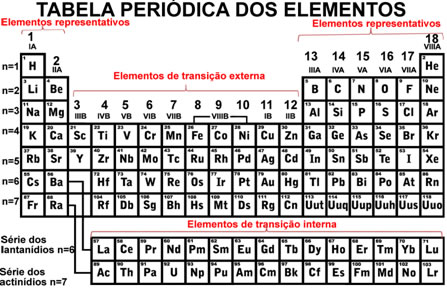
Os elementos de transição interna possuem o elétron mais energético do átomo no estado fundamental em um subnível f incompleto. A sua configuração eletrônica termina em ns2 (n - 2)f (1 até 13).
Exemplo com configuração eletrônica em ordem de energia:
57La: 1s2 / 2s2 2p6 / 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f1.
Por Jennifer Fogaça
Graduada em Química