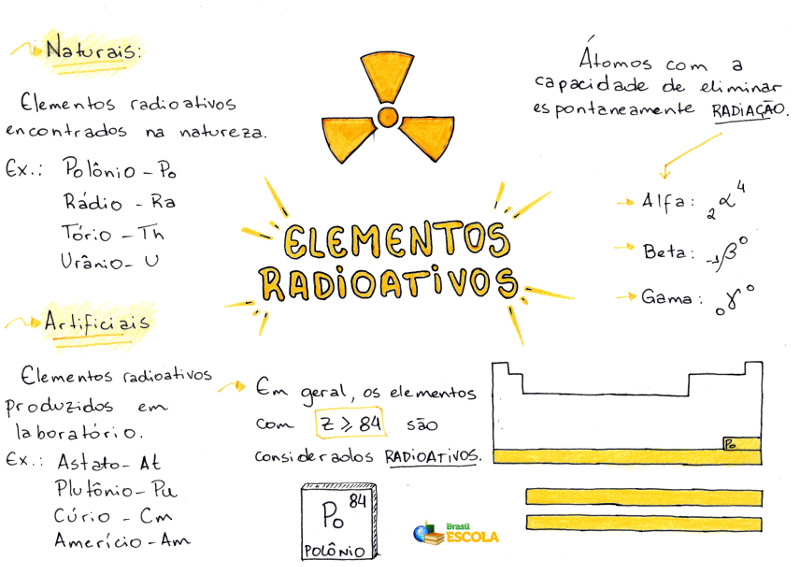
Denominam-se elementos radioativos aqueles que apresentam átomos com a capacidade de eliminar espontaneamente radiação (alfa, beta ou gama) a partir de seus núcleos.
Em geral, os elementos são considerados radioativos quando apresentam número atômico (indicativo do número de prótons no interior do núcleo do átomo) maior ou igual a 84, que é o número atômico referente ao elemento químico polônio.
Z ≥ 84
Todos os isótopos (átomos que possuem o mesmo número de prótons) dos elementos radioativos, isto é, que apresentam número atômico maior ou igual a 84, emitem radiação.
Tópicos deste artigo
- 1 - Elementos radioativos naturais
- 2 - Mapa Mental: Elementos radioativos
- 3 - Elementos radioativos artificiais
- 4 - Exceções relacionadas aos elementos radioativos
Elementos radioativos naturais
Os elementos radioativos naturais são aqueles em que todos os seus isótopos são radioativos e encontrados dessa forma na natureza. A seguir, a relação de todos os elementos radioativos naturais:
- Polônio (84Po);
- Radônio (86Rn);
- Rádio (88Ra);
- Actínio (89Ac);
- Tório (90Th);
- Protactínio (91Pa);
- Urânio (92U).
Mapa Mental: Elementos radioativos
*Baixe o mapa mental sobre elementos radioativos!
Elementos radioativos artificiais
Os elementos radioativos artificiais são aqueles em que todos os seus isótopos são radioativos e produzidos em laboratório, ou seja, não são encontrados dessa forma na natureza. A seguinte relação apresenta todos os elementos radioativos artificiais:
- Astato (85At);
- Frâncio (87Fr);
- Netúnio (93Np);
- Plutônio (94Pu);
- Amerício (95Am);
- Cúrio (96Cm);
- Berquélio (97Bk);
- Califórnio (98Cf);
- Einstênio (99Es);
- Férmio (100Fm);
- Mendelévio (101Md);
- Nobélio (102No);
- Laurêncio (103Lr);
- Rutherfórdio (104Rf);
- Dúbnio (105Db);
- Seabórgio (106Sg);
- Bóhrio (107Bh);
- Hássio (108Hs);
- Meitnério (109Mt);
- Darmstadtio (110Ds);
- Roentgênio (111Rg);
- Copernício (112Cn);
- Ninhônio (113Nh);
- Fleróvio (114Fl);
- Moscóvio (115Mc);
- Livermório (116Lv);
- Tenessino (117Ts);
- Oganosseno (118Og).
Exceções relacionadas aos elementos radioativos
“Por que o césio-137, material que gerou um grande acidente radiológico na cidade de Goiânia, não está em nenhuma das listas de elementos radioativos acima?”. Essa pergunta pode ter surgido ao ler o texto até aqui. Para respondê-la, é preciso saber uma informação fundamental: todo elemento químico, com número atômico menor ou igual a 84, deve apresentar ao menos um isótopo radioativo.
Como césio-137 é a expressão utilizada para indicar o isótopo do elemento césio que emite radiação a partir do núcleo de seu átomo e como esse elemento possui número atômico 55, ele, portanto, não apresenta todos os seus isótopos radioativos e, por isso, não está relacionado com os demais elementos radioativos.
Outro exemplo de elemento a apresentar número atômico menor que 84 e isótopos radioativos é o hidrogênio, cujo número atômico é igual a 1. Esse elemento possui três isótopos – prótio (1H1), deutério (1H2) e trítio (1H3) –, e o hidrogênio-3 é o radioativo.
* Mapa mental por Victor Ricardo Ferreira
Professor de Química
Por Me. Diogo Lopes Dias