O raio atômico é uma medida que descreve o tamanho de um átomo neutro. Refere-se à distância do núcleo até a camada mais externa de elétrons. O conceito de raio atômico teve sua origem no início do século XX, com os avanços da física quântica e a compreensão cada vez maior da estrutura atômica. Nesse sentido, o químico inglês Henry Moseley, em 1913, realizou experimentos que demonstraram a relação entre o número atômico (número de prótons no núcleo) e as propriedades dos elementos, fornecendo uma base mais sólida para a organização da tabela periódica.
Compreender o raio atômico é importante para diversas aplicações na química, incluindo a previsão de reações químicas e a compreensão das propriedades físicas dos elementos. Por exemplo, elementos com raios atômicos menores tendem a formar ligações mais fortes, enquanto aqueles com raios maiores são mais propensos a participar de reações que envolvem a transferência de elétrons. Desse modo, compreender esse assunto proporciona uma base sólida para explorar e manipular a química dos materiais.
Leia também: Eletronegatividade — outra propriedade periódica dos elementos químicos
Tópicos deste artigo
- 1 - Resumo sobre raio atômico
- 2 - Videoaula sobre raio atômico
- 3 - O que é raio atômico?
- 4 - Variação do raio atômico na tabela periódica
- 5 - Como calcular o raio atômico?
- 6 - Qual o elemento com o menor raio atômico?
- 7 - Qual o elemento com o maior raio atômico?
- 8 - Diferença entre raio atômico e raio iônico
- 9 - Exercícios resolvidos sobre raio atômico
Resumo sobre raio atômico
-
Raio atômico é a medida do tamanho de um átomo neutro, definida como a distância do núcleo até a camada mais externa de elétrons.
-
Na tabela periódica, o raio atômico aumenta de cima para baixo em um grupo e diminui da esquerda para a direita em um período.
-
O cálculo do raio atômico é geralmente feito de forma indireta, usando difração de raios X, dados espectroscópicos ou cálculos teóricos de mecânica quântica.
-
O elemento com o menor raio atômico é o hélio.
-
O elemento com o maior raio atômico é o frâncio.
-
Raio iônico refere-se ao tamanho de um íon, que é um átomo que ganhou ou perdeu elétrons.
-
Quando um átomo perde elétrons e se torna um cátion, seu raio iônico é menor que o raio atômico original.
-
Quando um átomo ganha elétrons e se torna um ânion, seu raio iônico é maior que o raio atômico original.
Videoaula sobre raio atômico
O que é raio atômico?
O raio atômico é uma medida do tamanho de um átomo neutro, geralmente definido como a distância do núcleo do átomo até a camada mais externa de elétrons.
Variação do raio atômico na tabela periódica
A variação do raio atômico na tabela periódica ocorre de maneira previsível, ou seja, trata-se de uma propriedade periódica. Nesse sentido, ao seguir de cima para baixo em um grupo (coluna), o raio atômico aumenta porque novos níveis de energia (camadas eletrônicas) são adicionados, fazendo com que os elétrons fiquem mais distantes do núcleo.
Por outro lado, da esquerda para a direita em um período (linha), o raio atômico diminui porque o número de prótons no núcleo aumenta, o que atrai os elétrons mais fortemente e puxa-os para mais perto do núcleo. Sendo assim, o tamanho do átomo diminui ao longo de um período, conforme é indicado na imagem abaixo:
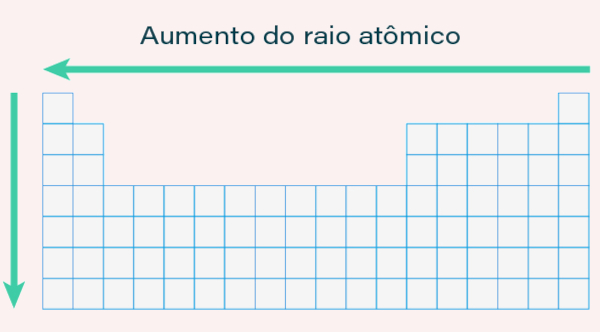
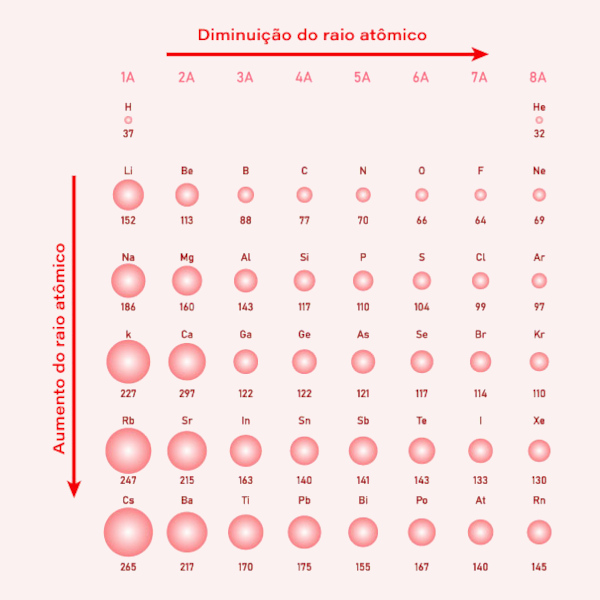
Para fins de comparação, veja os raios atômicos dos elementos representativos (família 1A – 7A) dispostos abaixo. Perceba que eles obedecem a uma sequência, aumentando de cima para baixo e da direita para a esquerda.
Como calcular o raio atômico?
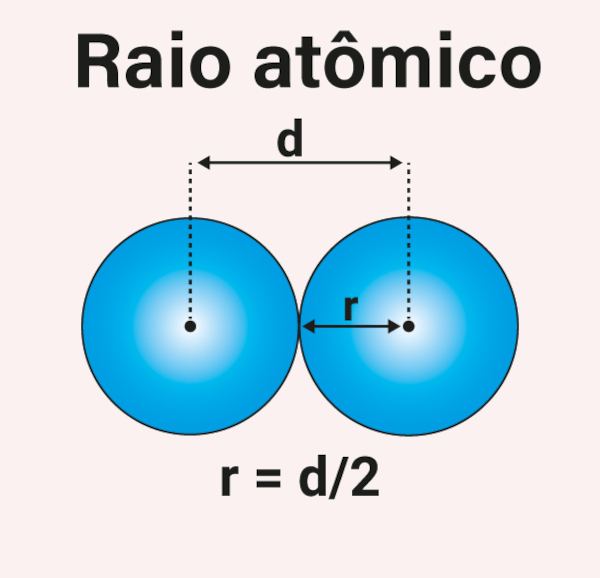
Calcular o raio atômico diretamente é bem complicado devido à natureza quântica dos elétrons que não orbitam o núcleo em trajetórias fixas. Em vez disso, o raio atômico é geralmente determinado de forma indireta. Por exemplo, uma abordagem comum é usar dados experimentais de difração de raios X ou medições espectroscópicas para determinar as distâncias entre núcleos de átomos em uma molécula ou em um cristal. Sendo assim, o raio atômico é então estimado como metade da distância entre os núcleos de dois átomos adjacentes conforme ilustrado a seguir.
Além disso, métodos de mecânica quântica possibilitam estimar a distribuição de densidade eletrônica ao redor do núcleo e, a partir disso, determinar o tamanho do átomo. Portanto, cabe ressaltar que esses métodos permitem obter valores precisos do raio atômico, que podem variar dependendo do ambiente químico e das interações entre átomos.
Veja também: Quais são as famílias da Tabela Periódica?
Qual o elemento com o menor raio atômico?
O elemento com o menor raio atômico é o hélio (He), o qual está localizado no canto superior direito da tabela periódica, no grupo dos gases nobres. Apesar de o hidrogênio estar na mesma linha e ter apenas um próton, o hélio tem uma carga nuclear maior (dois prótons) e ainda só possui duas camadas eletrônicas. Isso faz com que os elétrons do hélio sejam atraídos mais fortemente para o núcleo, resultando em um raio atômico menor em relação aos outros elementos.
Qual o elemento com o maior raio atômico?
Já o elemento com o maior raio atômico é o frâncio (Fr), porquanto está localizado no canto inferior esquerdo da tabela periódica, no grupo dos metais alcalinos, ou seja, tem muitos níveis de energia, o que significa que seus elétrons estão distribuídos em várias camadas eletrônicas. Logo, isso faz com que a camada mais externa de elétrons esteja muito distante do núcleo, resultando em um raio atômico maior comparado aos demais elementos.
Saiba mais: Qual é a estrutura de um átomo?
Diferença entre raio atômico e raio iônico
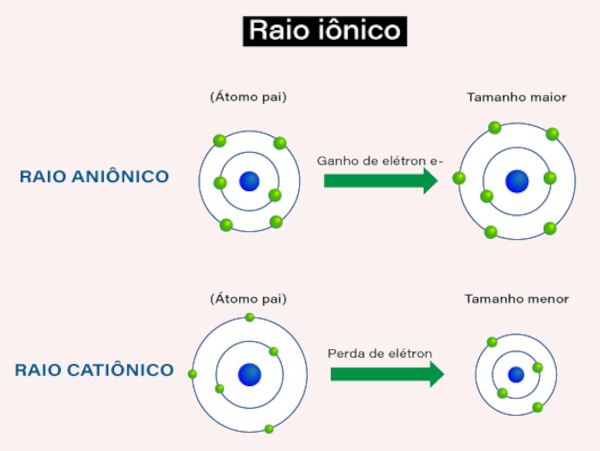
O raio iônico, assim como o raio atômico, estima tamanhos, mas com algumas diferenças importantes. O raio atômico descreve o tamanho de um átomo neutro, enquanto o raio iônico refere-se ao tamanho de um íon, e essas medidas podem variar significativamente devido às mudanças na carga elétrica e na distribuição dos elétrons. Nesse último caso temos duas possibilidades:
-
Quando um átomo perde elétrons e se torna um cátion (íon positivo), seu raio iônico é menor que o raio atômico original, pois a perda de elétrons reduz a repulsão entre eles, permitindo que os restantes sejam puxados mais perto do núcleo.
-
Em contrapartida, quando um átomo ganha elétrons e se torna um ânion (íon negativo), seu raio iônico é maior que o raio atômico original, pois a adição de elétrons aumenta a repulsão entre eles, fazendo com que se espalhem mais, conforme a ilustração abaixo para cada caso:
Exercícios resolvidos sobre raio atômico
1ª) (Udesc) De acordo com as propriedades periódicas dos elementos químicos, analise as proposições abaixo.
I. O tamanho do raio atômico dos elementos químicos cresce da direita para a esquerda nos periódicos e cresce de cima para baixo nos grupos.
II. O tamanho do raio atômico dos elementos químicos cresce da esquerda para direita nos periódicos, assim como a eletropositividade.
III. O iodo apresenta raio atômico menor do que o cloro.
IV. O nitrogênio apresenta raio atômico maior do que o flúor.
Analise a alternativa correta.
-
Somente a afirmativa I é verdadeira.
-
Somente as afirmativas II e III são verdadeiras.
-
Somente as afirmativas I e III são verdadeiras.
-
Somente as afirmativas I e IV são verdadeiras.
-
Somente as afirmativas II e IV são verdadeiras.
Gabarito: d
Os itens I e II se contrastam no que tange a periodicidade do raio atômico, sendo verdadeiro apenas o item I, pois na tabela periódica, da direita para a esquerda e de cima para baixo, há um aumento no número de camadas eletrônicas e o maior distanciamento da camada mais externa do núcleo atômico, tornando-a menos propensa aos efeitos da carga nuclear efetiva. Consequentemente o raio atômico será maior.
Ao verificarmos na tabela, percebe-se que o iodo está abaixo do cloro e, por isso, tem raio atômico maior. Sendo assim, o item III está errado. Por outro lado, o item IV está correto. O nitrogênio possui raio atômico maior, pois se encontra mais à esquerda no mesmo período que o flúor.
2ª) (UFGD) O raio iônico é o raio de um cátion ou de um ânion. Quando um átomo neutro se converte em um íon, espera-se uma mudança no seu tamanho. Em relação ao raio iônico, leia as seguintes afirmações.
-
O raio do Li+ é menor do que o raio do Li, pois o primeiro apresenta um elétron a menos.
-
Os íons Na+, F– e Mg²+ têm a mesma configuração eletrônica, porém seus raios são diferentes porque eles têm diferentes números atômicos.
-
O raio dos ânions é maior do que o raio dos átomos originais devido ao aumento do número de elétrons na camada de valência dos ânions e aos efeitos de repulsão que os elétrons exercem uns sobre os outros.
-
O raio iônico diminui de cima para baixo em um mesmo grupo na tabela periódica devido ao aumento sucessivo do número de camadas eletrônicas.
Estão corretas as afirmações em
-
I e II, apenas.
-
I, II e III, apenas.
-
II e III, apenas.
-
II e IV, apenas.
-
I e IV, apenas.
Gabarito: b
Vamos analisar cada item separadamente:
I - Está correto, pois ao remover um elétron de um átomo neutro, o raio atômico diminui.
II - Devemos verificar as configurações eletrônicas:
sódio neutro: 1s² 2s² 2p⁶ 3s¹. Ao perder um elétron para se tornar Na⁺, fica: 1s² 2s² 2p⁶.
flúor neutro: 1s² 2s² 2p⁵. Ao ganhar um elétron para se tornar F⁻, fica: 1s² 2s² 2p⁶.
magnésio neutro: 1s² 2s² 2p⁶ 3s². Ao perder dois elétrons para se tornar Mg²⁺, fica: 1s² 2s² 2p⁶.
De fato, eles possuem a mesma configuração eletrônica, mas seus números de prótons são diferentes. O que significa que o tamanho dos raios atômicos também será distinto. (correto)
III – Correto, é exatamente o que acontece.
IV – O raio iônico diminui aumenta de cima para baixo em um mesmo grupo na tabela periódica devido ao aumento sucessivo do número de camadas eletrônicas. (errado)
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. A periodicidade. In: Princípios de Química: questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 51–60.
L. BROWN, T. et al. Tamanho de átomos e íons. In: Química: a ciência central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 276–278.
RAHM, M.; HOFFMANN, R.; ASHCROFT, N. W. Atomic and Ionic Radii of Elements 1–96. Chemistry - A European Journal, v. 22, n. 41, p. 14625–14632, 2016.
WELLER, M. et al. Raios atômicos e iônicos. In: Química Inorgânica. 6. ed. Porto Alegre: Bookman, 2017. p. 22–25.



