Elétrons são partículas subatômicas com carga elétrica negativa. A palavra “elétron” é derivada do termo grego “ἤλεκτρον” (elektron), que significa “âmbar”. Diante disso, a escolha desse termo foi baseada na observação de fenômenos elétricos que ocorrem quando o âmbar é esfregado e atrai objetos leves, um fenômeno conhecido desde a Antiguidade. Posteriormente, descobriu-se que os elétrons possuem carga elétrica negativa e compõem os átomos, juntamente com os prótons e os nêutrons.
Localizados em torno do núcleo do átomo em regiões chamadas de camadas ou níveis de energia, desempenham um papel crucial na Química e na eletricidade, pois são responsáveis pela formação de ligações químicas entre átomos e pela condução de corrente elétrica.
Leia também: Distribuição eletrônica — representação da forma como os elétrons estão organizados nos átomos
Tópicos deste artigo
- 1 - Resumo sobre os elétrons
- 2 - O que são elétrons?
- 3 - Localização dos elétrons
- 4 - Função dos elétrons
- 5 - Propriedades dos elétrons
- 6 - História dos elétrons
- 7 - Prótons, nêutrons e elétrons
- 8 - Exercícios resolvidos sobre elétrons
Resumo sobre os elétrons
-
Elétrons são partículas subatômicas com carga elétrica negativa.
-
Eles orbitam em torno do núcleo de um átomo em regiões chamadas orbitais.
-
Possuem uma massa muito pequena em comparação com prótons e nêutrons.
-
A carga de um elétron é aproximadamente -1,602 x 10-19 coulombs.
-
A descoberta dos elétrons é creditada a J.J. Thomson em 1897 a partir de uma série de experimentos com raios catódicos.
-
Desempenham um papel crucial em fenômenos elétricos e químicos.
-
Prótons, nêutrons e elétrons são partículas subatômicas.
-
Enquanto os elétrons possuem carga elétrica negativa, os prótons possuem carga elétrica positiva, e os nêutrons não possuem carga elétrica.
O que são elétrons?
Os elétrons são partículas subatômicas fundamentais que orbitam em torno do núcleo de um átomo e que têm uma carga elétrica negativa. Sua massa é muito pequena em comparação com os prótons e nêutrons no núcleo. A massa de um elétron é aproximadamente 1/1836 da massa de um próton.
Localização dos elétrons
Os elétrons estão localizados em torno do núcleo do átomo. No entanto, é importante salientar que embora o modelo planetário seja replicado para fins didáticos, os elétrons não se movem em órbitas fixas como planetas ao redor do sol, mas sim em regiões de alta probabilidade de encontrar um elétron. Dessa forma, eles ocupam regiões do espaço chamadas orbitais, que representam as prováveis posições onde podem ser encontrados com base na teoria quântica.
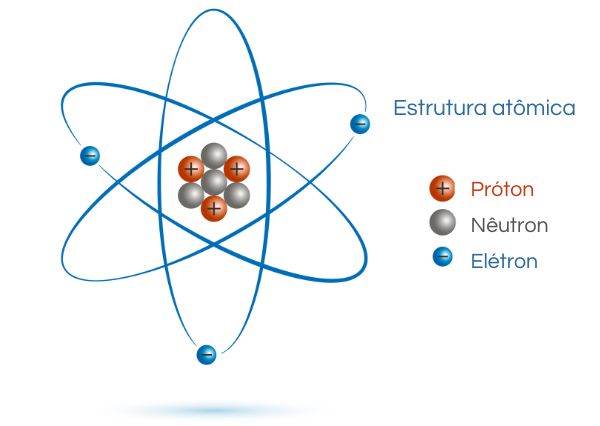
Vale destacar ainda que a distribuição dos elétrons em torno do núcleo é organizada em camadas ou níveis de energia, em que cada camada pode conter um número máximo de elétrons e é dividida em subníveis de energia (s, p, d, f), que representam diferentes formas de orbitais. Sendo assim, veja a seguir como é feita distribuição dos elétrons nas órbitas do átomo de sódio (Na):
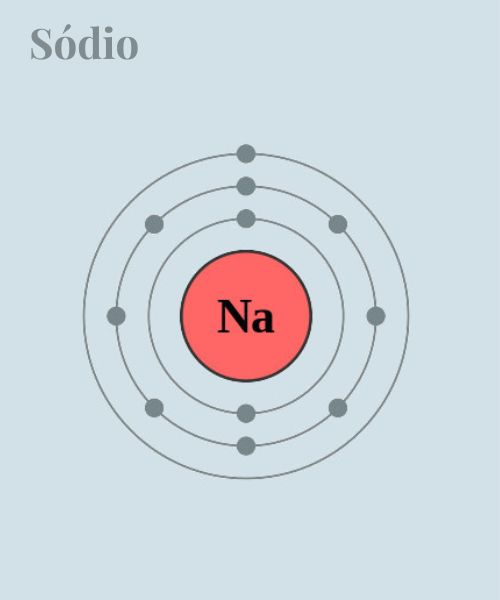
Diante disso, é importante ressaltar que os elétrons externos, também conhecidos como elétrons de valência, são os mais importantes para as propriedades químicas de um átomo, pois estão envolvidos na formação de ligações químicas com outros átomos. Parte superior do formulárioParte superior do formulário
Função dos elétrons
Os elétrons desempenham diversas funções no comportamento da matéria:
-
Nos metais, eles conduzem a corrente elétrica ao moverem-se livremente através da estrutura cristalina.
-
Os elétrons de valência dos átomos desempenham um papel crucial na formação de ligações químicas, pois pelo fato de estarem na camada mais externa da eletrosfera, eles podem ser compartilhados entre átomos, resultando em ligações covalentes, ou transferidos de um átomo para outro, formando ligações iônicas, o que dá origem a moléculas e compostos químicos.
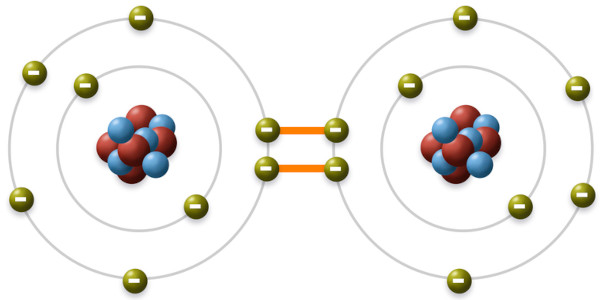
-
Os elétrons também determinam a configuração eletrônica de um átomo, influenciando suas propriedades químicas e físicas. Sem contar que, em átomos e moléculas, os elétrons podem absorver energia e saltar para níveis mais elevados, emitindo essa energia na forma de luz quando retornam ao estado fundamental. Essa característica auxilia na identificação de substâncias por meio de técnicas analíticas.
Propriedades dos elétrons

Assim como outras partículas subatômicas, os elétrons apresentam propriedades que determinam sua natureza onda-partícula e consequentemente o seu comportamento como constituinte da matéria. Diante disso, veja a seguir as principais propriedades dos elétrons:
-
Carga elétrica: os elétrons têm uma carga elétrica negativa, sendo aproximadamente -1,602 x 10-19 coulombs.
-
Massa: os elétrons têm uma massa muito pequena em comparação com prótons e nêutrons, sendo cerca de 9,109 x 10-31 quilogramas, o que é aproximadamente 1/1836 da massa de um próton.
-
Spin: possuem uma propriedade intrínseca chamada spin, que é uma forma de momento angular. O spin do elétron pode ter dois valores possíveis: +1/2 ou -1/2.
-
Dualidade onda-partícula: os elétrons exibem comportamento tanto de partícula quanto de onda, de acordo com a teoria quântica. Essa dualidade é uma das características fundamentais da mecânica quântica.
-
Momentum: os elétrons em movimento têm momentum, que é uma combinação de sua massa e velocidade.
-
Propriedades magnéticas: os elétrons têm um momento magnético intrínseco devido ao seu spin. Isso contribui para as propriedades magnéticas dos materiais.
-
Carga fracionária: embora os elétrons tenham uma carga elementar de -1, em certos contextos, como em sistemas quânticos fracionários, eles podem se comportar como se tivessem uma carga fracionária.
Acesse também: Isoelétrons — átomos ou íons que possuem o mesmo número de elétrons
História dos elétrons
A história dos elétrons está intrinsecamente ligada ao desenvolvimento da Física e da Química. Nesse sentido, bem antes da descoberta do átomo feita por Thomson, já havia indícios da existência dessas partículas, isto é, desde os tempos antigos, as pessoas observavam fenômenos elétricos, como a atração de objetos leves por âmbar quando esfregado. No entanto, não havia compreensão científica desses fenômenos. Sendo assim, veja como essa ideia se desenvolveu ao longo dos séculos:
-
Século XVII: o físico inglês William Gilbert cunhou o termo “eletricidade” em seu livro “De Magnete” (1600) para descrever o fenômeno de atração de objetos por âmbar e outros materiais após serem esfregados.

- Século XVIII: a eletricidade começou a ser mais estudada experimentalmente. Benjamin Franklin propôs a teoria de que havia dois tipos de eletricidade, “positiva” e “negativa”. Ele usou o termo “elétrons” para descrever partículas que transportavam eletricidade. Essa foi uma ideia precursora à descoberta dos elétrons.
-
Século XIX: com o desenvolvimento da teoria atômica, cientistas como J.J. Thomson começaram a investigar a estrutura do átomo e, em 1897, Thomson realizou experimentos com tubos de raios catódicos e descobriu os elétrons. Ele determinou sua relação com a carga elétrica e sua massa, abrindo caminho para a compreensão moderna da estrutura atômica.
- Século XX: a partir da descoberta dos elétrons, a física de partículas começou a se desenvolver rapidamente. Ernest Rutherford propôs o modelo do átomo com um núcleo central positivo e elétrons orbitando ao redor dele, enquanto Niels Bohr expandiu esse modelo, desenvolvendo a teoria dos níveis de energia e quantização do movimento dos elétrons.
-
A partir do século XX: com o desenvolvimento da mecânica quântica, a natureza ondulatória dos elétrons foi mais bem compreendida, juntamente com sua natureza de partícula. Novos modelos atômicos e teorias, como o modelo orbital e o modelo da nuvem eletrônica, foram desenvolvidos para descrever a distribuição dos elétrons em torno do núcleo atômico.
-
Atualmente: os elétrons são amplamente compreendidos como partículas fundamentais da matéria, com propriedades bem definidas que desempenham um papel crucial na Química, na eletricidade, na eletrônica e em muitos outros campos da ciência e da tecnologia.
Veja também: Modelo “pudim de passas” — o modelo atômico proposto por J. J. Thomson
Prótons, nêutrons e elétrons
Prótons, nêutrons e elétrons são partículas subatômicas. Até aqui você pôde ter uma noção do que são os elétrons, mas um átomo também é formado pelos prótons e nêutrons, ambos localizados no núcleo atômico. Nesse sentido, enquanto os elétrons possuem carga elétrica negativa, os prótons possuem carga elétrica positiva e os nêutrons não possuem carga elétrica, ou seja, são partículas neutras. Essas três partículas formam a estrutura básica de um átomo. Sendo assim, para fins de comparação, observe o quadro abaixo com as propriedades de cada um:
|
Propriedade |
Próton |
Nêutron |
Elétron |
|
Carga elétrica |
Positiva (+1,602 x 10-19 C) |
Neutra (0 C) |
Negativa (-1,602 x 10-19 C) |
|
Localização |
Núcleo do átomo |
Núcleo do átomo |
Orbitando ao redor do núcleo |
|
Massa |
Aprox. 1,67 x 10-27 kg |
Aprox. 1,67 x 10-27 kg |
Aprox. 9,11 x 10-31 kg |
|
Carga Relativa |
+1 |
0 |
-1 |
|
Estabilidade |
Relativamente estável |
Relativamente estável |
Em constante movimento |
|
Papel em reações |
Determina o número atômico e contribui para o nº de massa |
Contribui para o nº de massa |
Envolvido em interações químicas |
C = Coulomb.
Exercícios resolvidos sobre elétrons
Questão 1
A descoberta dos elétrons foi um marco na Física e Química moderna, pois foi possível compreender melhor o comportamento de certos materiais e desenvolvimento de novas tecnologias. Diante disso, qual experimento realizado por J.J. Thomson em 1897 permitiu a identificação dos elétrons?
A) Experimento da dupla fenda
B) Experimento da gota de óleo
C) Experimento do tubo de raios catódicos
D) Experimento da difração de elétrons
E) Experimento da eletrólise
Resolução:
Alternativa C.
Thomson realizou uma série de experimentos com raios catódicos em que ele observou que esses raios eram desviados em direção ao polo positivo do campo magnético, sugerindo que as partículas nos raios tinham carga negativa.
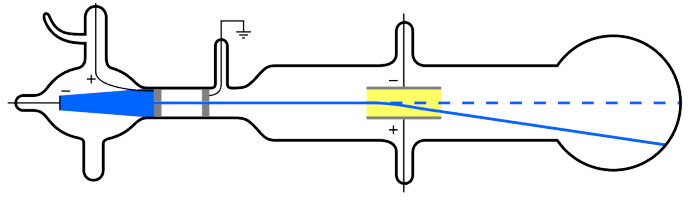
Questão 2
(Enem) No final do século XIX, muitos cientistas estavam interessados nos intrigantes fenômenos observados nas ampolas de raios catódicos, que são tubos sob vácuo em que se ligam duas placas a uma fonte de alta tensão. Os raios catódicos passam através de um orifício no ânodo e continuam o percurso até a outra extremidade do tubo, onde são detectados pela fluorescência produzida ao chocarem-se com um revestimento especial, como pode ser observado na figura. Medições da razão entre a carga e a massa dos constituintes dos raios catódicos mostram que a sua identidade independe do material do cátodo ou do gás dentro das ampolas.
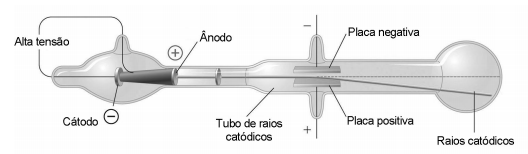
CHANG, R.; GOLDSBY, K. A. Química. Porto Alegre: Bookman, 2013 (adaptado).
Essa radiação invisível detectada nas ampolas é constituída por:
A) ânions
B) cátions
C) prótons
D) elétrons
E) partículas alfa
Resolução:
Alternativa D.
O raio catódico sofreu um desvio causado pela placa positiva, indicando que parte dos seus constituintes era formada por partículas carregadas negativamente, que nesse caso são os elétrons.
Crédito de imagem
Pumbaa / Greg Robson / Wikimedia Commons (Imagem editada: A palavra “sodium” foi traduzida, os outros escritos foram apagados e a cor do fundo foi alterada.)
Fontes
FALCONE, I. J J Thomson and the discovery of the electron. Physics Education, v. 32, n. 4, p. 226–231, 1997.
FALCONER, I. Corpuscles, Electrons and Cathode Rays: J.J. Thomson and the ‘Discovery of the Electron’. The British Journal for the History of Science, v. 20, n. 3, p. 241–276, 1987.
GERWARD, L. The discovery of the electron: A centenary. Physics Education, v. 32, n. 4, p. 219–225, 1997.
MELONI, R. A.; BIANCO, A. A. G. As Representações de Diagramas de Níveis de Energia dos Elétrons em Livros Didáticos de Química - 1960/1970. Revista Debates em Ensino de Química, v. 8, n. 3, p. 377–393, 2021.
MORROW, B. A. On the discovery of the electron. Journal of Chemical Education, 1969.
PEAKE, B. M. The discovery of the electron, proton, and neutron. Journal of Chemical Education, v. 66, n. 9, p. 738, 1989.
ROBOTTI, N. The discovery of the electron: I. European Journal of Physics, v. 18, n. 3, p. 133–138, 1997.
ZUFFO, J. A. A tecnologia e a infossociedade. Encyclopaedia of Philosophy of Education, v. 3, p. 310, 2003.




