A ligação iônica é um tipo de ligação química caracterizada pela interação eletrostática de íons de cargas opostas. É uma ligação considerada forte, com compostos sólidos em temperatura ambiente e possuindo também altas temperaturas de fusão.
A ligação iônica é possível, na maioria das vezes, entre um metal e um ametal, pois o primeiro tem grande tendência de perder elétrons, enquanto o segundo tem grande tendência de ganhar elétrons. Assim, é comum dizer que os elementos dos compostos iônicos são quimicamente antagônicos.
Leia também: Ligação metálica — a ligação química que ocorre entre metais
Tópicos deste artigo
- 1 - Resumo sobre ligação iônica
- 2 - Videoaula sobre ligação iônica
- 3 - Características da ligação iônica
- 4 - Elementos que fazem parte da ligação iônica
- 5 - Como fazer a ligação iônica?
- 6 - Íon-fórmula
- 7 - Fórmula eletrônica de Lewis
- 8 - Diferenças entre ligação iônica e ligação covalente
- 9 - Exercícios resolvidos sobre ligação iônica
Resumo sobre ligação iônica
- A ligação iônica é uma modalidade de ligação química caracterizada pela interação entre um cátion e um ânion.
- Em geral, é formada por um metal e um ametal, pois o metal tem grande tendência de perder elétrons, enquanto o ametal tem grande tendência de ganhar elétrons.
- A ligação iônica é uma ligação considerada forte, e os compostos gerados são sólidos em temperatura ambiente, apresentando alta temperatura de fusão.
- A ligação iônica pode ser representada didaticamente de duas formas: pela íon-fórmula ou pela estrutura de Lewis.
Videoaula sobre ligação iônica
Características da ligação iônica
Uma ligação iônica é a interação eletrostática (atrações coulômbicas) existente entre duas cargas: um cátion e um ânion. A interação entre vários ânions e cátions dá origem a um composto iônico, em que todos os cátions, de certa forma, interagem com todos os ânions, porém todos os cátions se repelem e todos os ânions também se repelem.
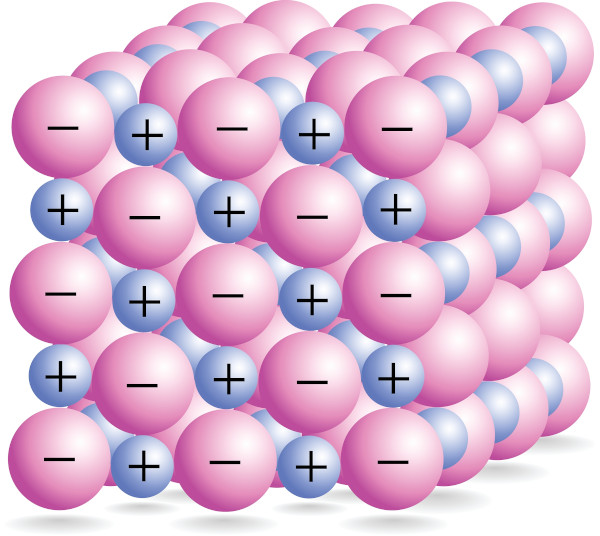
Essa ligação é uma ligação química considerada forte, com os compostos sendo sólidos em temperatura ambiente, necessitando de altas temperaturas para sua fusão. Em geral, também são quebradiços, pois um golpe com um objeto duro imediatamente faz aproximar íons de cargas iguais, que, logo após, separam-se, fazendo o sólido se partir em pedaços.
Elementos que fazem parte da ligação iônica
Em geral, os elementos pertencentes a uma ligação iônica apresentam grande diferença de eletronegatividade (maior que 1,7, para boa parte dos autores). Contudo, também é possível dizer que há maior tendência de ocorrer ligação iônica entre um átomo com baixa energia de ionização (um metal, por exemplo) e um átomo com alta afinidade eletrônica (um ametal, por exemplo).
Isso porque, pelas regras de estabilidade atômica (como a 0,), os metais costumam formar cátions, enquanto os ametais costumam forma ânions. Essa característica antagônica é que permite a formação da ligação iônica.
Como fazer a ligação iônica?
A formação de fato de uma ligação iônica não é tão simples. Por exemplo, vamos pensar no sólido iônico NaCl, conhecido como cloreto de sódio, o famoso sal de cozinha e um dos maiores exemplos de composto iônico.
No caso do elemento químico sódio (Na), cujo número atômico é 11, sua distribuição eletrônica nos permite dizer que sua camada de valência é 3s1. Por isso, o sódio tem a tendência de perder um elétron para adquirir a configuração do gás nobre mais próximo da Tabela Periódica, neste caso, o neônio (Ne, Z = 10).
Quando o sódio perde um elétron, mais especificamente no estado gasoso, estamos descrevendo a energia de ionização do sódio:
Na (g) → Na+ (g) + e– Energia necessária: 494 kJ.mol-1
Já para o elemento químico cloro (Cl), cujo número atômico é 17, sua distribuição eletrônica demonstra que tal átomo possui sete elétrons em sua camada de valência (3s2 3p5). Assim, é possível perceber que o cloro tem a tendência de formar um ânion de carga -1, assim adquirindo a configuração eletrônica do gás nobre mais próximo de si na Tabela Periódica, o argônio (Ar, Z = 18).
Ao receber um elétron, estamos demonstrando a afinidade eletrônica do cloro:
Cl (g) + e– → Cl– (g) Energia liberada: 349 kJ.mol-1
Fazendo um balanço energético geral dos dois processos acima, percebe-se que a formação dos íons não é favorável, ou seja, gera-se um aumento de energia no sistema (494 kJ.mol-1 – 394 kJ.mol-1 = + 145 kJ.mol-1). Assim, fica a dúvida: como então o sólido se estabiliza?
De fato, para que a ligação iônica ocorra, tais íons devem estar próximos (e não isolados), para que surjam as interações eletrostáticas. Quando íons Na+ e Cl– se aproximam, forma-se uma rede cristalina, estabilizada pela chamada energia de rede.
Na+ (g) + Cl– (g) → NaCl (s) Energia liberada: 787 kJ.mol-1
Assim, no balanço energético geral, percebe-se uma diminuição da energia igual a 145 kJ.mol-1 – 787 kJ.mol-1 = –642 kJ.mol-1, ou seja, a atração entre os íons de cargas opostas é que estabiliza o composto iônico, por meio da energia de rede.
Veja também: O que são substâncias iônicas?
Íon-fórmula
Um composto iônico é uma estrutura infinita de cargas de sinais opostos que se repetem até as extremidades da substância, porém, em nível de representação, exige-se apenas a íon-fórmula, a fórmula mínima do composto iônico. Por exemplo, vamos ver o caso do composto NaCl:
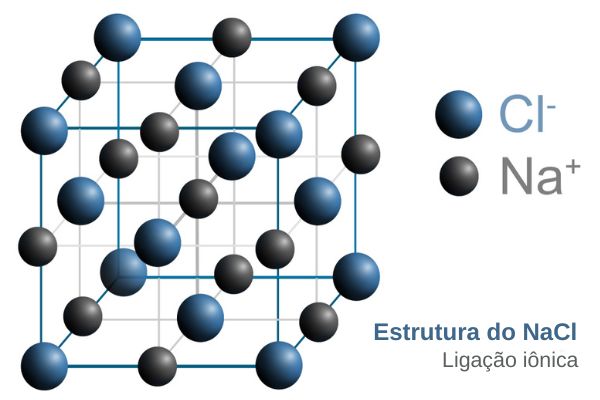
Como é possível perceber, cada cátion Na+ (esferas menores e mais escuras) está diretamente ligado a seis ânions Cl–, que, por sua vez, estão diretamente ligados a outros seis cátions Na+. Assim, para representar os seis cátions e seis ânions, pode-se dizer que o composto iônico entre sódio e cloro é o Na6Cl6.
No entanto, fórmulas químicas devem ser representadas com os menores números inteiros possíveis, e, por isso, como a íon-fórmula é uma fórmula química, representa-se o cloreto de sódio como NaCl, em que os índices de atomicidade são iguais a 1.
Fórmula eletrônica de Lewis
A formação de um composto iônico envolve muitos movimentos dos átomos envolvidos: perda de elétrons, ganho de elétrons, aproximação, formação da rede cristalina etc. Nesse ponto, o cientista Gilbert Newton Lewis criou uma fórmula (ou diagrama) para prever a fórmula de um composto iônico por meio de seus cátions e ânions.
Vamos nos ater ao caso do NaCl novamente. Pelo diagrama de Lewis, os elementos devem ter seus elétrons de valência representados por pequenos pontos em sua proximidade. O sódio, no caso, só teria um único ponto (um elétron de valência), enquanto o cloro teria sete (já que possui sete elétrons de valência).
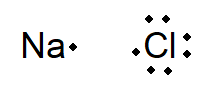
Na formação do composto final, sabendo que os compostos iônicos são eletricamente neutros, o diagrama de Lewis representa o átomo de cloro com um íon a mais, tornando-se o íon Cl–, enquanto representa o sódio com um íon a menos, tornando-se o íon Na+.
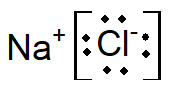
Perceba que, com base na estrutura de Lewis, é possível alcançar a íon-fórmula.
O diagrama de Lewis também é útil para prever compostos iônicos em que a carga do cátion e a do ânion são de módulos diferentes. Esse é o caso do composto iônico formado entre magnésio, Mg, que possui dois elétrons na camada de valência, e o bromo, Br, que também possui setes elétrons na camada de valência, já que é um halogênio, como o cloro. Na estrutura de Lewis, tem-se que:
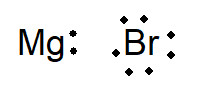
Para adquirir maior estabilidade, o magnésio tende a perder os dois elétrons de valência e, assim, adquirir a configuração eletrônica do neônio, Ne, o gás nobre mais próximo dele na Tabela Periódica. Contudo, o bromo tende a ganhar um elétron para, assim, ter a mesma configuração eletrônica do gás nobre criptônio, Kr.
Como um composto iônico deve ser eletricamente neutro, é necessário que sempre haja dois ânions Br– para cada íon Mg2+ e, por isso, fórmula final do composto é MgBr2.
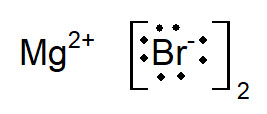
Foi da estrutura de Lewis que, provavelmente, saiu a ideia de que durante uma ligação iônica há “doação” de elétrons de um átomo para o outro. Isso não é verdade, já que não há como comprovar que os íons perdidos pelo magnésio serão necessariamente adquiridos pelos átomos de bromo, por exemplo. Contudo, tal mecanismo é muito comum, e é por isso que se vê, em alguns livros, setas indicando um elétron migrando para outro átomo, conforme a imagem a seguir.
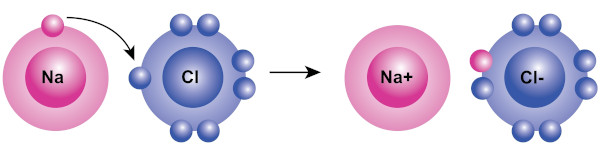
Contudo, tal mecanismo acaba tendo o mesmo resultado do diagrama de Lewis, pois prevê, de forma adequada, a íon-fórmula dos compostos iônicos.
Acesse também: Diagrama de Linus Pauling — uma ferramenta que prevê várias características e propriedades de um átomo
Diferenças entre ligação iônica e ligação covalente
O objetivo da ligação química, seja iônica, seja covalente, é sempre o mesmo: garantir maior estabilidade para os elementos envolvidos. Contudo, a forma como um elemento se liga a outro é diferente.
No caso da ligação covalente, os compostos compartilham a densidade eletrônica, criando uma região de atração entre os núcleos atômicos. Nesse movimento, não há perda e ganho de cargas e formação de rede cristalina, como ocorre na ligação iônica. Isso é consequência da natureza dos átomos que fazem a ligação covalente, pois, de modo geral, são ametais, com valores próximos de eletronegatividade, energia de ionização e afinidade eletrônica.
Por exemplo, pensemos no composto covalente O2F2. Tanto oxigênio (O) quanto flúor (F) são elementos de alta eletronegatividade e de grande afinidade eletrônica. De que forma haveria maior estabilidade se um desses elementos perdesse elétrons? É contra a sua natureza.
Exercícios resolvidos sobre ligação iônica
Questão 1
(Enem) A fosfatidilserina é um fosfolipídio aniônico cuja interação com cálcio livre regula processos de transdução celular e vem sendo estudada no desenvolvimento de biossensores nanométricos. A figura representa a estrutura da fosfatidilserina:
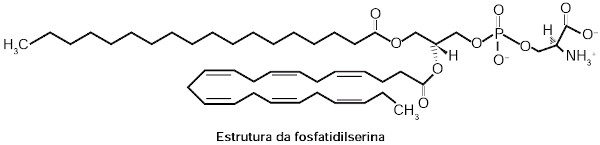
MEROLLI, A.; SANTIN, M. Role of phosphatidylserine in bone repair and its technological exploitation. Molecules, v. 14, 2009.
Com base nas informações do texto, a natureza da interação da fosfatidilserina com o cálcio livre é do tipo
Dado: número atômico do elemento cálcio: 20
A) iônica somente com o grupo aniônico fosfato, já que o cálcio livre é um cátion monovalente.
B) iônica com o cátion amônio, porque o cálcio livre é representado como um ânion monovalente.
C) iônica com os grupos aniônicos fosfato e carboxila, porque o cálcio em sua forma livre é um cátion divalente.
D) covalente com qualquer dos grupos não carregados da fosfatidilserina, uma vez que estes podem doar elétrons ao cálcio livre para formar a ligação.
E) covalente com qualquer grupo catiônico da fosfatidilserina, visto que o cálcio na sua forma livre poderá compartilhar seus elétrons com tais grupos.
Resolução:
Alternativa C
A fosfatidilserina apresenta dois grupos aniônicos (negativos): o grupo fosfato e o grupo carboxila. O cálcio livre é, na verdade, o cálcio na sua forma catiônica. Tendo 20 prótons, o cálcio também tem 20 elétrons e, assim, a distribuição eletrônica desse elemento demonstra que ele possui dois elétrons na camada de valência (no subnível 4s2). Assim, para se estabilizar segundo a regra do octeto, o cálcio deve perder dois elétrons, tornando-se um cátion divalente.
Assim, a natureza de interação será iônica, porque, sendo o cálcio um íon positivo, ele interagirá com as regiões negativas da molécula.
Questão 2
(Enem) Os compostos iônicos CaCO3 e NaCl têm solubilidades muito diferentes em água. Enquanto o carbonato de cálcio, principal constituinte do mármore, é praticamente insolúvel em água, o sal de cozinha é muito solúvel.
A solubilidade de qualquer sal é o resultado do balanço entre a energia de rede (energia necessária para separar completamente os íons do sólido cristalino) e a energia envolvida na hidratação dos íons dispersos em solução.
Em relação à energia de rede, a menor solubilidade do primeiro composto é explicada pelo fato de ele apresentar maior
A) atração entre seus íons.
B) densidade do sólido iônico.
C) energia de ionização do cálcio.
D) eletronegatividade dos átomos.
E) polarizabilidade do íon carbonato.
Resolução:
Alternativa A
Os íons presentes no CaCO3 são divalentes (possuem cargas iguais a +2 e -2), enquanto no NaCl os íons presentes são monovalentes (possuem cargas iguais a +1 e -1). Assim, quanto maior a carga, maior a atração, dificultando a separação dos íons para a consequente hidratação.
Por Stéfano Araújo Novais
Professor de Química


