Os íons são espécies químicas carregadas eletricamente e são formados por átomos que perderam ou receberam elétrons. Os cátions são íons positivos derivados da perda de elétrons por átomos neutros. Já os ânions são íons negativos formados pelo recebimento de elétrons por átomos neutros.
As ligações iônicas são ligações químicas muito fortes e formadas pela doação e pelo recebimento de elétrons por um par cátion/ânion, que se mantêm unidos pela forte interação eletrostática entre suas cargas.
Leia também: Oxirredução — um processo químico em que há transferência de elétrons entre elementos de uma reação química
Tópicos deste artigo
- 1 - Resumo sobre íons
- 2 - Videoaula sobre íons
- 3 - O que são íons?
- 4 - Classificação dos íons
- 5 - Como os íons são formados?
- 6 - Para que servem os íons?
- 7 - Quais as diferenças entre íons, átomos e moléculas?
- 8 - Ligação iônica
- 9 - Exercícios resolvidos sobre íons
Resumo sobre íons
- Íons são espécies químicas carregadas eletricamente.
- Formam-se por meio de átomos eletricamente neutros.
- O átomo, ao perder elétron, forma um íon positivo chamado cátion.
- O átomo, ao receber elétron, forma um íon negativo chamado ânion.
- Ligações iônicas se formam pela doação/recebimento de elétrons entre um cátion e um ânion, os quais passam a se atrair eletrostaticamente.
- Os íons são fundamentais para o funcionamento de organismos vivos.
- Soluções contendo íons conduzem corrente elétrica e são importantes para a construção de pilhas e baterias.
Videoaula sobre íons
O que são íons?
Os íons são espécies químicas eletricamente carregadas resultantes de átomos que perderam ou receberam elétrons. Os átomos são eletricamente neutros por possuírem iguais quantidades de partículas carregadas positivamente (prótons) e negativamente (elétrons).
Assim, o átomo neutro, ao receber elétrons adicionais, fica com excesso de carga negativa, formando um íon negativo, e, se o átomo neutro perde seus elétrons originais, ficará com ausência dessas cargas, representada por uma carga numérica positiva, originado um íon positivo.
- Exemplos de íons negativos: F-, Cl-, O2-.
- Exemplos de íons positivos: H+, K+, Fe2+.
Os íons podem ser simples, quando formados por um único elemento químico, ou compostos, quando formados por mais de um elemento químico.
- Exemplos de íons simples: Na+, Ca2+, Br-, O2-.
- Exemplos de íons compostos: NH4+, SO4-, CO32-.
Classificação dos íons
Os íons são classificados de acordo com a sua carga resultante após o processo de perder ou receber elétrons. O valor da carga dos íons é equivalente às unidades de elétrons perdidas ou recebidas.
→ Cátions
Os íons com carga positiva são denominados cátions e são formados por átomos eletricamente neutros que perderam elétrons, conforme representação pela equação abaixo:
\(X\longrightarrow X^{n+}+n\ e^-\ \)
O termo n representa a quantidade de elétrons perdidos e a carga gerada no íon. Por exemplo, o átomo de sódio (Na) perde um elétron para formar o íon positivo sódio (Na+). Como esse elemento perde um único elétron, sua carga será 1+:
\(Na\longrightarrow{Na}^++1\ e^-\ \)
Já o átomo de cálcio (Ca) perde dois elétrons, formando o íon positivo cálcio (Ca2+). Como esse elemento perde dois elétrons, o cátion resultante possui carga 2+:
\(Ca\longrightarrow{Ca}^{2+}+2\ e^-\)
→ Ânions
Os íons de carga negativa são denominados ânions e são derivados de átomos eletricamente neutros que receberam elétrons, conforme representação pela equação abaixo:
\(Y+n\ e^-\longrightarrow Y^{n-}\ \)
O termo n representa a quantidade de elétrons recebida e a carga gerada no íon. Por exemplo, o elemento flúor (F) é capaz de receber um único elétron, formando o íon negativo flúor (F-):
\(F+1\ e^-\longrightarrow F^-\ \)
O elemento oxigênio (O) consegue receber até dois elétrons, dando origem ao íon negativo O2-:
\(O+2\ e^-\longrightarrow O^{2-}\)
→ Classificação de cátions e ânions
Os cátions e ânions podem ser classificados de acordo com o valor de carga adquirido:
|
Classificação |
Carga do cátion |
Carga do ânion |
Exemplos |
|
Monovalente |
+1 |
-1 |
K+, Cl- |
|
Divalente |
+2 |
-2 |
Mg2+, S2- |
|
Trivalente |
+3 |
-3 |
Fe3+, PO43- |
|
Tetravalente |
+4 |
-4 |
Pb4+, C4- |
Como os íons são formados?
Os íons podem ser formados por diferentes mecanismos. No processo de ionização, os íons são formados pela remoção de elétrons da camada de valência do átomo neutro.
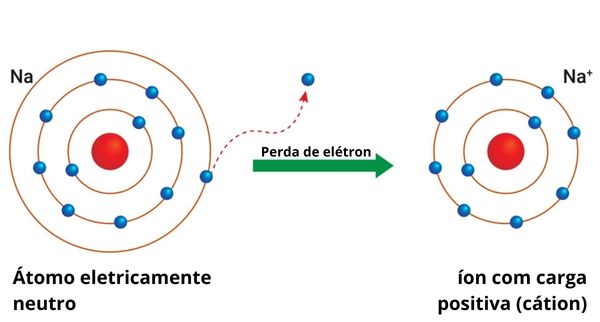
A remoção de um ou mais elétrons de um átomo requer energia. Esse valor de energia é específico para cada tipo de elemento químico e é conhecido como energia de ionização, uma das propriedades periódicas.
Por exemplo, para remover o único elétron de valência do átomo de sódio (Na), é necessária uma energia de 496 kJ:
\(Na+496\ kJ\longrightarrow{Na}^++1\ e^-\)
Os metais são espécies químicas com baixa energia de ionização e, por isso, possuem a tendência de perderem seus elétrons de valência, formando cátions.
A ionização também dá origem aos ânions. Nesse caso, é comum empregar a propriedade de afinidade eletrônica para indicar a quantidade de energia liberada no processo de um átomo neutro receber um ou mais elétrons, tornando-se um íon negativo.
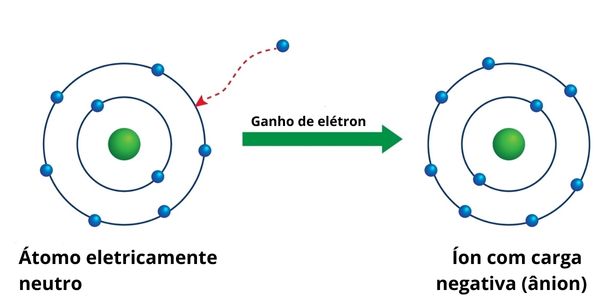
Por exemplo, para adicionar um elétron à camada de valência do átomo de cloro (Cl), é necessária uma energia de 349 kJ:
\(Cl+{1\ e}^-\longrightarrow{Cl}^-+349\ kJ\)
A propriedade de afinidade eletrônica, ou eletroafinidade, é uma propriedade periódica e, assim como a energia de ionização, possui tendência de variação conhecida na Tabela Periódica.
Os ametais são espécies com altas afinidades eletrônicas e, por isso, têm forte tendência em formar ânions.
Outra forma de íons serem formados é por meio do processo de cisão heterolítica de uma ligação covalente. Nessa situação, ao ser rompida a ligação covalente, os elétrons compartilhados entre as duas espécies migram para um dos átomos, que se torna um ânion, deixando o outro átomo com falta de elétrons, tornando-se um cátion.
Saiba mais: Como é feita a distribuição eletrônica de íons?
Para que servem os íons?
Os íons são espécies químicas fundamentais e estão envolvidos em inúmeros processos, possuindo uma infinidade de funções. Uma das mais importantes é a manutenção da saúde nos organismos vivos, uma vez que os íons são agentes fundamentais para muitas funções vitais.
No corpo humano, a deficiência de íons pode levar ao desenvolvimento de doenças, como atrasos no crescimento por falta de íons zinco; anemia causada por deficiência de íons ferro; má formação óssea ou osteoporose causada por falta de íons cálcio.
Os íons potássio são essenciais para os processos de contração muscular. A bomba de sódio-potássio funciona baseada nesses íons e é um mecanismo de transporte ativo no corpo. As sinapses neurais ocorrem com a utilização de íons cálcio e sódio. Esses são apenas alguns exemplos da importante função dos íons nos organismos vivos.

Outra notável função dos íons é a capacidade de formar soluções eletrolíticas, as soluções aquosas que conduzem corrente elétrica. Graças às soluções eletrolíticas que dispositivos de armazenamento de energia foram desenvolvidos, como as pilhas, as baterias de automóveis e as baterias de dispositivos eletrônicos.
A fertilidade de solos também está associada aos íons presentes. A análise química do solo determina a sua composição química (incluindo os íons presentes), então se calcula as quantidades adequadas de adubo e calcário necessários para garantir uma boa saúde às plantas.
A acidez ou basicidade das substâncias químicas se devem à ação dos íons hidrogênio e íons hidroxila respectivamente. As medidas de acidez e basicidade são expressas por meio da escala de pH.
Quais as diferenças entre íons, átomos e moléculas?
Os íons, os átomos e as moléculas são espécies químicas diferentes.
- Íons: são espécies com carga elétrica, formados quando os átomos perdem ou recebem elétrons.
- Átomos: são a estrutura fundamental da matéria, formados por um núcleo, contendo prótons e nêutrons, e por uma região chamada eletrosfera, em que ficam os elétrons. Os átomos são eletricamente neutros porque possuem iguais quantidade de prótons (partículas positivas) e de elétrons (partículas negativas).
- Moléculas: são formadas quando um ou mais átomos se ligam quimicamente por meio de ligações covalentes, também são eletricamente neutras.
Ligação iônica
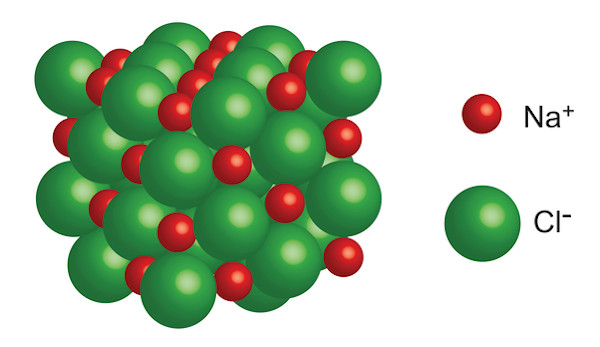
A ligação iônica é um tipo de ligação química e é formada pela atração eletrostática entre íons de cargas opostas, originando os compostos iônicos.
A formação da ligação iônica se dá pela perda de elétrons por um átomo de baixa energia de ionização, que os cede para outro átomo que possua elevada afinidade eletrônica. Nesse processo, há a formação de um cátion e de um ânion, que, em razão das cargas elétricas opostas, se atraem mutuamente e de forma intensa, dando origem a uma estrutura cristalina muito bem ordenada geometricamente.
Isso significa que a atração eletrostática entre cátions e ânions é tão forte nos compostos iônicos, que se formam sólidos extremamente duros e de estrutura bem determinada.
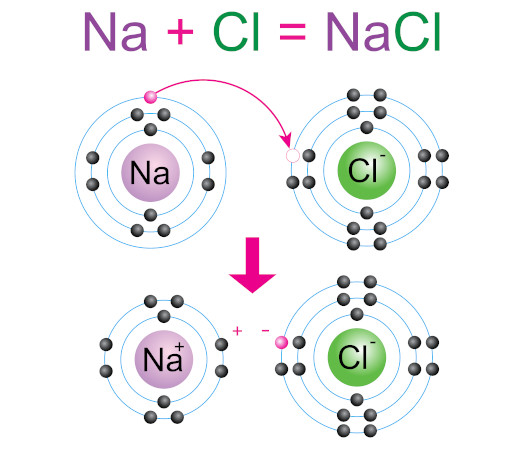
A ilustração abaixo representa a formação do composto iônico cloreto de sódio (NaCl) por meio do estabelecimento de uma ligação iônica entre o átomo de sódio e o átomo de cloro. Perceba que o sódio perde seu elétron de valência, formando o cátion sódio (Na+). Esse elétron é recebido pelo átomo de cloro, formando o íon cloro (Cl-). Os dois íons formados se atraem fortemente, formando a estrutura iônica do cloreto de sódio.
Exercícios resolvidos sobre íons
Questão 1
Quando um átomo eletricamente neutro recebe elétrons, ele se torna:
A) um ânion, espécie que possui maior número de elétrons do que número de prótons.
B) um cátion, espécie que possui menor número de elétrons do que número de prótons.
C) outro átomo de número atômico mais elevado.
D) um átomo com carga elétrica positiva.
E) uma molécula com carga elétrica negativa.
Resolução:
Alternativa A
Quando um átomo eletricamente neutro recebe elétrons, ele se torna um ânion, que é um íon com carga elétrica negativa, afinal o elétron é uma partícula com carregada negativamente. Nessa configuração, o número de prótons não se altera e o número de elétrons aumenta-se.
Questão 2
O íon alumínio trivalente é representado como Al3+. Essa representação indica que:
I. se trata de um ânion.
II. o íon alumínio possui três elétrons a mais que o átomo neutro.
III. o átomo de alumínio perdeu três elétrons.
IV. um cátion foi formado.
Estão corretas apenas as afirmativas:
A) I e II
B) I e III
C) II e III
D) II, III e IV
E) III e IV
Resolução:
Alternativa E
A representação Al3+ indica que o átomo de alumínio perdeu 3 elétrons, transformando-se em um íon positivo, que se chama cátion. Dessa forma, apenas estão corretas as afirmativas III e IV.
Por Ana Luiza Lorezen Lima
Professora de Química