As ligações covalentes podem ocorrer na forma Molecular ou Dativa e Coordenada.
Ligação covalente molecular
Nessa ligação, os átomos são unidos devido ao compartilhar de seus elétrons, surgem então os pares eletrônicos indicados pelo círculo:
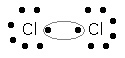
Ligação covalente molecular de dois átomos de Cloro (Cl).
Cada par eletrônico formado pertence simultaneamente aos dois átomos. As moléculas são estruturas eletricamente neutras porque não ocorre nem ganho nem perda de elétrons, apenas o compartilhamento.
A água é um composto molecular constituído por dois átomos de hidrogênio (H2) e um de oxigênio (O).
Ligação covalente dativa e coordenada
Essa ligação obedece a Teoria do Octeto: Os átomos se unem tentando adquirir oito elétrons na camada de valência, ou seja, a configuração eletrônica dos gases nobres.
Sendo assim, um átomo que já atingiu a estabilidade eletrônica se une a outro que necessita de elétrons para completar a camada de valência. Um exemplo dessa ligação é quando um átomo de enxofre se liga a dois de oxigênio para formar o dióxido de enxofre (SO2).
![]()
O átomo de enxofre (S) adquire seu octeto com formação de uma dupla ligação com o oxigênio localizado à esquerda (ligação coordenada), mas ao mesmo tempo o oxigênio posicionado à direita necessita de elétrons para completar seu octeto. Surge então a ligação covalente dativa representada por um pequeno vetor (seta). A seta indica que o “S” está doando um par de elétrons para o “O”.
Vejamos o compartilhamento de elétrons na formação do composto trióxido de enxofre (SO3).
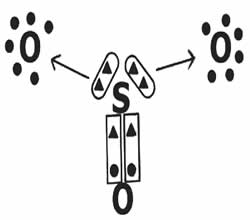
Note que o elemento central (enxofre) estabelece uma dupla ligação (coordenada) com um dos oxigênios, atingindo a estabilidade eletrônica (oito elétrons na camada de valência). Por outro lado, doa dois pares de elétrons para os oxigênios (ligação dativa indicada pela seta →) na tentativa de completar o octeto.
Por Líria Alves
Graduada em Química

