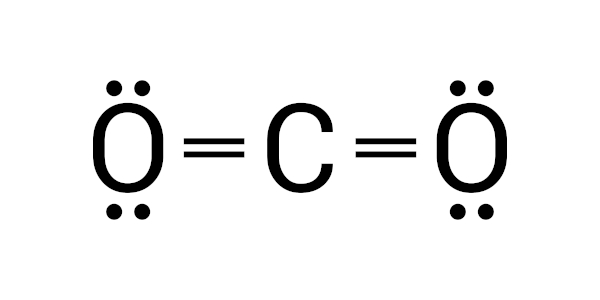Fórmulas químicas são formas de representação da composição ou da estrutura de compostos químicos, independentemente da sua natureza. Graças a elas, podemos identificar os elementos presentes e as quantidades de cada um, bem como a natureza das ligações que são exercidas.
Podem ser diversas, como a fórmula molecular, a íon-fórmula, a fórmula mínima, a fórmula centesimal e as fórmulas estruturais. Cada fórmula traz uma informação diferente e, muitas vezes, deve ser usada em conjunto para uma verdadeira leitura do composto analisado.
Leia também: Quais são as fórmulas estruturais do carbono?
Tópicos deste artigo
- 1 - Resumo sobre fórmulas químicas
- 2 - O que são fórmulas químicas?
- 3 - Tipos de fórmulas químicas
- 4 - Como calcular a fórmula química?
- 5 - Tabela de fórmulas químicas
- 6 - Exercícios resolvidos sobre fórmulas químicas
Resumo sobre fórmulas químicas
- Fórmulas químicas são formas de representar os compostos químicos, seja com base na composição, seja com base na estrutura.
- Representam os mais diversos compostos presentes em Química, independentemente da sua natureza.
- As fórmulas químicas podem identificar elementos presentes, a quantidade de cada elemento, assim como a natureza das ligações realizadas.
- Dentre as fórmulas químicas, podemos citar a fórmula molecular, a íon-fórmula, a fórmula mínima, a fórmula centesimal e as fórmulas estruturais (convencional, condensada e bastão).
O que são fórmulas químicas?
As fórmulas químicas são formas de representação da composição ou da estrutura da substância química, que pode ser iônica, covalente ou metálica. São úteis para identificar os elementos presentes, a quantidade relativa de cada um, assim como identificam as ligações que os elementos fazem entre si, podendo, ainda, trazer informações acerca da geometria e da disposição espacial.
Tipos de fórmulas químicas
Os principais tipos de fórmulas químicas utilizadas estão listados a seguir.
-
Fórmula molecular
Representa os constituintes de um composto covalente, bem como a quantidade relativa de cada um por unidade molecular. É o caso de H2O (em que a molécula é feita de 2 átomos de hidrogênio e 1 átomo de oxigênio) e do H3PO4 (em que a molécula é feita de 3 átomos de hidrogênio, 1 átomo de fósforo e 4 átomos de oxigênio).
-
Íon-fórmula (ou fórmula iônica)
Mesma ideia da fórmula molecular, porém para compostos iônicos, ou seja, representa os constituintes de um composto iônico, bem como a quantidade relativa de cada um. É o caso de CaCl2 (em que são necessários 2 ânions Cl− para neutralizar o cátion Ca2+) e do KBr (em que é necessário 1 ânion Br− para neutralizar o cátion K+).
Alguns compostos iônicos não são eletricamente neutros, como é o caso de PO43−, que indica que a unidade iônica é feita de 1 cátion P5+ e 4 ânions O2−, gerando uma carga total igual a -3, representada no canto superior direito.
-
Fórmula mínima (ou empírica)
Representa a fórmula molecular ou a íon-fórmula com os menores inteiros possíveis. Por exemplo, o ácido etanoico apresenta a fórmula molecular C2H4O2, contudo todos seus índices podem ser representados pelo menor número possível caso eles sejam divididos por 2, chegando-se à fórmula CH2O, a fórmula mínima do ácido etanoico.
Alguns autores já utilizam a íon-fórmula como uma fórmula mínima, embora outros prefiram fazer a distinção. É o caso do NaCl, cloreto de sódio. Ao se avaliar a estrutura cristalina desse composto iônico, percebe-se que cada cátion Na+ está envolto por 6 ânions Cl−, assim como cada ânion Cl− está envolto por 6 cátions Na+, o que nos levaria a uma íon-fórmula Na6Cl6, com fórmula empírica NaCl.
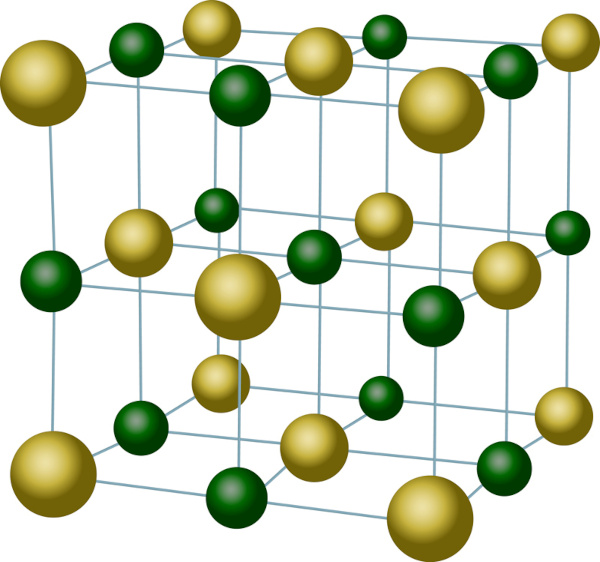
A fórmula mínima também é muito usada para representar compostos metálicos, uma vez que a estrutura metálica é representada por uma infinidade de átomos. Portanto, para representar o ferro metálico, basta utilizar Fe. O mesmo ocorre para algumas ligas metálicas. Por exemplo, Cu2Sn representa um tipo de bronze em que, para cada 2 átomos de cobre, existe 1 átomo de estanho.
-
Fórmula centesimal
Representa o percentual mássico de cada constituinte presente na fórmula. Embora possa ser usada para qualquer tipo de composto, a representação centesimal é mais comum para ligas metálicas. Por exemplo, o aço inoxidável 304 (um tipo de aço inox), tem a seguinte composição percentual: 0,07% de carbono, 17,50% de cromo, 2,00% de manganês, 1,00% de silício, 0,045% de fósforo, 0,015% de enxofre, 10,50% de níquel, 0,10% de nitrogênio e 68,77% de ferro.
A água, H2O, por exemplo, tem 11,11% em massa de hidrogênio e 88,89% de oxigênio. Alguns autores, por exemplo, representam a água, em termos centesimais, como H11,11%O88,89%.
-
Fórmula estrutural
Como o nome deixa a entender, a fórmula estrutural serve para representar a estrutura de uma molécula, explicitando as ligações que ocorrem entre os elementos. Assim, é muito útil para entender quais elementos estão se ligando, bem como a modalidade da ligação covalente. É muito usada para compostos orgânicos, embora também seja apresentada para compostos inorgânicos.
-
Fórmula estrutural condensada
O grande número de átomos de hidrogênios em estruturas orgânicas acaba causando um pouco de poluição visual. Por conta disso, alguns autores optam por condensar a fórmula estrutural, deixando os átomos de hidrogênio colados aos átomos de carbono, representando sua quantidade de forma similar à fórmula molecular. Essa metodologia também pode se aplicar para outros átomos, como oxigênio e nitrogênio, dando mais destaque para os carbonos.
-
Fórmula estrutural em bastão
É uma representação minimalista das estruturas orgânicas, em que os átomos de carbono e hidrogênio são omitidos, dando destaque para as ligações químicas (que são os bastões).
Veja também: Como identificar as ligações químicas?
Como calcular a fórmula química?
As fórmulas químicas podem ser calculadas, com exceção das fórmulas estruturais. Por exemplo, a fórmula molecular ou a íon-fórmula podem ser utilizadas para calcular a fórmula mínima e a fórmula centesimal, e vice-versa. As fórmulas estruturais não podem ser calculadas, mas sim obtidas das fórmulas moleculares, e vice-versa. Vejamos alguns exemplos a seguir.
→ Fórmula mínima x fórmula molecular/íon-fórmula
A fórmula mínima pode ser obtida diretamente da fórmula molecular ao se fazer uma breve análise. Por exemplo, a glicose tem fórmula molecular C6H12O6, e, ao se avaliar tal fórmula molecular, percebe-se que ela não está com os menores inteiros possíveis, uma vez que todos os índices são divisíveis por 6. Por isso, a fórmula mínima da glicose é CH2O.
Do contrário, deve-se saber a massa molar (ou molecular) do composto para se determinar a fórmula molecular a partir da fórmula mínima. Por exemplo, suponha que um composto, de fórmula mínima CH2O, tenha massa molar igual a 180 g/mol. Ao se determinar a massa molar da fórmula mínima, tem-se que:
MM(CH2O) = 12 + 2 ∙ 1 + 16 = 30 g/mol
Ao dividir-se a massa molar do composto pela massa molar da fórmula mínima, tem-se que:
180 / 30 = 6
Assim sendo, é possível concluir que a fórmula molecular é composta por 6 unidades de fórmula mínima, assim: 6 ∙ CH2O, sendo então C6H12O6.
Algumas vezes a fórmula mínima coincide com a fórmula molecular, como é o caso do composto K2Cr2O7, em que não há um divisível em comum para todos os índices apresentados.
→ Fórmula centesimal x fórmula molecular/íon-fórmula
No caso da fórmula centesimal, o percentual corresponde à participação mássica de cada elemento na fórmula. Continuemos com a glicose, C6H12O6, cuja massa molar é de 180 g/mol. Desses 180 gramas, 72 gramas são referentes ao carbono, 12 gramas são referentes ao hidrogênio e 96 gramas são referentes ao oxigênio. Assim, em termos percentuais, podemos dizer que a fórmula centesimal da glicose é:
C = 40,00%
H = 6,67%
O = 53,33%
Da mesma forma, podemos chegar à fórmula molecular por meio da composição centesimal. Contudo, caso o composto tenha uma fórmula mínima diferente da fórmula molecular, tal método alcançará, apenas, a fórmula mínima, uma vez que ela tem o mesmo percentual mássico da fórmula molecular.
- 1º passo: dividir o percentual de cada elemento por sua massa molar:
C = 40,00/12 = 3,33
H = 6,67/1 = 6,67
O = 53,33/16 = 3,33
- 2º passo: agora, dividir o valor obtido de cada elemento pelo menor valor obtido na etapa anterior, que, no caso, foi 3,33.
C = 3,33/3,33 = 1
H = 6,67/3,33 = 2
O = 3,33/3,33 = 1
Assim, a molécula em questão tem a proporção de 1 carbono para 2 hidrogênios e 1 oxigênio. Isso nos faz chegar à fórmula molecular CH2O, a fórmula mínima da glicose. Para se chegar à fórmula mínima correta da glicose, é preciso saber a sua massa molar, que no caso é 180 g/mol. Com isso, como visto no item anterior, pode-se calcular o número de unidades de fórmula mínima necessárias para formar a fórmula molecular.
→ Fórmula estrutural x fórmula molecular
No caso da fórmula estrutural, por vezes, a estrutura pode apresentar um número maior de probabilidades de montagem. Um exemplo clássico é o N2O. Dessa forma, não se sabe se a estrutura de Lewis correta seria N=O=N, N≡N−O ou N=N=O, por exemplo.
Para se chegar a tal conclusão, usa-se o conceito de carga formal (CF), calculada pela seguinte expressão:
CF = (nº elétrons de valência) – (nº de elétrons não ligantes) – (0,5 ∙ nº de elétrons ligantes)
Quanto menor for a carga formal dos participantes da estrutura, mais estável é a estrutura.
No caso do N2O, podemos determinar o número de elétrons de valência de nitrogênio e oxigênio pela distribuição eletrônica:
N → 1s2 2s2 2p3, ou seja, 5 elétrons de valência.
O → 1s2 2s2 2p4, ou seja, 6 elétrons de valência.
Com isso, temos as seguintes possibilidades:
|
Estrutura |
|
|
Carga formal |
N → 5 – 4 – (0,5 ∙ 4) = −1 |
|
O → 6 – 0 – (0,5 ∙ 8) = +2 |
|
Estrutura |
|
|
Carga formal |
N (ponta) → 5 – 4 – (0,5 ∙ 4) = −1 |
|
N (central) → 5 – 0 – (0,5 ∙ 8) = +1 |
|
|
O → 6 – 4 – (0,5 ∙ 4) = 0 |
|
Estrutura |
|
|
Carga formal |
N (ponta) → 5 – 2 – (0,5 ∙ 6) = 0 |
|
N (central) → 5 – 0 – (0,5 ∙ 8) = +1 |
|
|
O → 6 – 6 – (0,5 ∙ 2) = −1 |
Com base nas cargas formais, as estruturas N=N=O e N≡N−O são as mais estáveis para o N2O. Ambas são válidas para representar o composto e, no caso, admite-se que existe ressonância entre as duas (são equivalentes).
N=N=O ↔ N≡N−O
Tabela de fórmulas químicas
A tabela a seguir resume um mesmo composto com suas diferentes fórmulas químicas. Usaremos como exemplo a glicose.
|
Composto |
Glicose |
|
Fórmula molecular |
C6H12O6 |
|
Fórmula mínima |
CH2O |
|
Fórmula centesimal |
C40,00%H6,67%O53,33% |
|
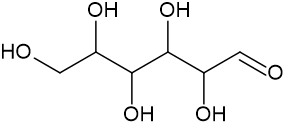
Fórmula estrutural |
|
|
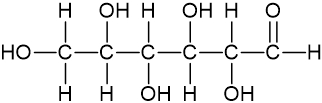
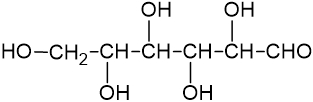
Fórmula estrutural condensada |
|
|
Fórmula estrutural em bastão |
|
Saiba mais: Geometria molecular — forma de representar o arranjo especial dos átomos em uma molécula
Exercícios resolvidos sobre fórmulas químicas
Questão 1. (Unifor Medicina/2024.1) O fármaco Y é um medicamento utilizado como anti-inflamatório e analgésico. A análise centesimal do referido fármaco revelou a seguinte composição: 60,0% de carbono; 4,5% de hidrogênio; e 35,5% de oxigênio.
Qual é a fórmula mínima do fármaco Y?
A) C2H2O
B) C2H2O2
C) C3H2O3
D) C4H8O
E) C5H4O2
Resposta: Letra A.
Para chegarmos à fórmula mínima, dividimos os percentuais pelas respectivas massas molares.
C → 60/12 = 5
H → 4,5/1 = 4,5
O → 35,5/16 = 2,2
Agora, devemos dividir os valores obtidos pelo menor valor obtido, que, no caso, foi 2,2:
C → 5/2,2 = 2,3 ≈ 2
H → 4,5/2,2 = 2
O → 2,2/2,2 = 1
Por isso, a fórmula mínima para o composto é C2H2O.
Questão 2. (Unieva Medicina/2023.1) Os fenóis são compostos orgânicos com uma ou mais oxidrilas (OH) ligadas diretamente ao anel aromático. Alguns dos fenóis são encontrados na natureza, como o eugenol, vanilina, timol e outros. O eugenol é um óleo essencial, presente em diversas espécies vegetais, inclusive no cravo-da-índia e tem despertado o interesse das indústrias farmacêutica e odontológica devido a suas propriedades anti-inflamatória, antimicrobiana e neuroprotetora.
A composição centesimal do Eugenol é de 73,20% de Carbono (C), 7,32% de Hidrogênio (H) e 19,48% de Oxigênio (O), aproximadamente. A sua massa molecular é de 164 g.
Considerando o exposto, a quantidade de C, H e O (aproximadamente), encontrada, constitui a fórmula molecular do eugenol, que é
A) C10H12O2.
B) C12H12O3.
C) C10H14O.
D) C12H10O2.
Resposta: Letra A.
Para se chegar à fórmula mínima, devemos dividir os percentuais pela massa molar de cada elemento presente:
C → 73,20/12 = 6,10
H → 7,32/1 = 7,32
O → 19,48/16 = 1,22
Agora, dividimos os valores obtidos pelo menor valor obtido, que no caso foi 1,22:
C → 6,10/1,22 = 5
H → 7,32/1,22 = 6
O → 1,22/1,22 = 1
Assim, a fórmula mínima do composto é C5H6O.
Contudo, para saber a fórmula molecular correta, devemos utilizar a massa molar do composto, que é 164 g/mol. É preciso ver quantas vezes a massa molar do composto verdadeiro é maior que a massa molar da fórmula mínima para saber quantas unidades de fórmula mínima estão no composto verdadeiro.
A massa molar da fórmula mínima é: 5 ∙ 12 + 6 ∙ 1 + 16, que é igual a 82 g/mol.
Ao se dividir 164 por 82, chega-se ao valor de 2; logo, o composto em questão tem 2 unidades de fórmula mínima, sendo então 2 ∙ C5H6O, que é C10H12O2.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
FRANCISCO, F. M.; DO CANTO, E. L. Química na abordagem do cotidiano. 5ª ed. vol. 1. São Paulo: Moderna, 2009.
REIS, M. Química: ensino médio. 2ª ed. vol. 1. São Paulo: Ática, 2016.
USBERCO, J.; SPITALERI, P.; SALVADOR, E. Química 1: conecte live. 3ª ed. vol. 1. São Paulo: Saraiva, 2018.