O magnésio, número atômico 12, é um metal acinzentado pertencente ao grupo 2 da Tabela Periódica, também conhecido como o grupo dos metais alcalinoterrosos. Foi isolado, pela primeira vez, em 1808, por Sir Humphry Davy, por meio de técnicas eletrolíticas. É o oitavo elemento mais abundante da crosta terrestre e o terceiro mais abundante do mar.
O magnésio finamente dividido, quando queimado, produz uma luz branca de grande intensidade e brilho e, por isso, ele está na composição de fogos de artifício. Esse elemento também se destaca na medicina, por estar presente no sal de Epsom e no leite de magnésia, além de ser muito importante para os sistemas biológicos, participando de diversas reações bioquímicas e sendo o átomo central da porfirina clorofila.
Tópicos deste artigo
- 1 - Resumo sobre magnésio
- 2 - Propriedades do magnésio
- 3 - Características do magnésio
- 4 - Onde o magnésio pode ser encontrado?
- 5 - Obtenção do magnésio
- 6 - Aplicações do magnésio
- 7 - Magnésio para a saúde
- 8 - História do magnésio
- 9 - Exercícios sobre magnésio
Resumo sobre magnésio
-
O magnésio é um metal acinzentado pertencente ao grupo dos metais alcalinoterrosos.
-
Quando finamente dividido, sua combustão produz uma luz branca e intensa.
-
É o oitavo elemento mais abundante da crosta terrestre, sendo encontrado principalmente nos minerais magnesita e dolomita.
-
Pode ser produzido por eletrólise ou decomposição térmica.
-
É usado em ligas metálicas e medicamentos, entre outros.
-
É muito importante para os seres vivos, sendo o átomo central da porfirina clorofila.
-
Foi isolado pela, primeira vez, em 1808, por Sir Humphry Davy.
Propriedades do magnésio
-
Símbolo: Mg
-
Número atômico: 12
-
Massa atômica: 24,3050 u.m.a
-
Eletronegatividade: 1,31
-
Ponto de fusão: 650 °C
-
Ponto de ebulição: 1090 °C
-
Densidade: 1,738 g.cm-3 (a 20 °C)
-
Configuração eletrônica: 3s2
-
Série química: grupo 2, metais alcalinoterrosos
Características do magnésio

O magnésio, quando na sua forma metálica, apresenta uma coloração acinzentada, sendo maleável, dúctil e um pouco quebradiço. Em contato com o ar, a superfície brilhante logo fica escurecida por conta da oxidação, que forma o óxido de magnésio na superfície. O óxido de magnésio superficial, contudo, protege a substância metálica interna.
Quando finamente dividido, o magnésio metálico entra em ignição em contato com o ar se a temperatura estiver mais elevada. A chama da queima do magnésio é branca e extremamente brilhante.

Quanto à reatividade, o magnésio é atacado pelo ácido nítrico, mas não é capaz de reagir com soluções alcalinas.
Leia mais: O que é combustão?
Onde o magnésio pode ser encontrado?

O magnésio é fácil de ser encontrado tanto na crosta terrestre quanto no mar. Isso porque, na crosta, ele figura como o oitavo elemento mais abundante, enquanto, no mar, é o terceiro mais abundante. Não à toa, são conhecidos mais de 80 minerais que têm, pelo menos, 20% em massa de magnésio.
Entre as principais fontes de magnésio, temos a magnesita (MgCO3), um carbonato de magnésio com teor médio de 47,8% de MgO e 52,2% de CO2. Outro mineral importante é a dolomita, uma mistura dos carbonatos de cálcio e magnésio. O magnésio ainda pode ser encontrado na olivina (um silicato de ferro e magnésio, (Mg,Fe)2SiO4) e na carnalita (um cloreto duplo de potássio e magnésio, KCl e MgCl2).
Obtenção do magnésio
As técnicas de obtenção de magnésio são basicamente duas: eletrólise ou decomposição térmica.
Na eletrólise, a principal fonte de partida de magnésio é o cloreto de magnésio anidro (sem água). O cloreto de magnésio pode ser oriundo de um mineral, como da carnalita, mas também da água do mar (muito comum nos Estados Unidos).
No segundo caso, o hidróxido de magnésio, Mg(OH)2, é precipitado pela ação do Ca(OH)2. Depois, o hidróxido de magnésio é neutralizado pelo ácido clorídrico, que, com a evaporação da água, gera o sal cloreto de magnésio parcialmente hidratado (MgCl2·xH2O). Depois, basta o sal ser aquecido até uma temperatura de cerca de 700 °C para então se tornar anidro. Posteriormente, a eletrólise segue com cloreto de magnésio fundido, obtendo-se o magnésio metálico (líquido) no cátodo.
Etapa de neutralização: 2 HCl + Mg(OH)2 → MgCl2 + 2 H2O
Reação catódica: Mg2+ (l) + 2e- → Mg (l)
Reação anódica: 2 Cl- (l) → Cl2 (g) + 2e-
Já na decomposição térmica (ou redução térmica), os carbonatos de cálcio e magnésio oriundos da dolomita são termicamente decompostos nos óxidos de cálcio e magnésio respectivamente. Assim, óxido de magnésio é reduzido pela ação do ferrossilício (FeSi), em um processo químico cuja temperatura deve ficar na casa dos 1200 ºC a 1600 °C:
2 MgO + 2 CaO + FeSi → 2 Mg + Ca2SiO4 + Fe
O magnésio é separado por meio de uma destilação em vácuo. A decomposição térmica é a técnica de produção em larga escala de magnésio utilizada na China.
-
Videoaula sobre eletrólise
Aplicações do magnésio
O brilho intenso e branco da queima do magnésio o colocou no mundo da fotografia. Embora novas tecnologias tenham sido desenvolvidas, talvez ainda seja possível encontrar magnésio em lâmpadas e flashes para iluminar cenários e fotografias. Também é comum a colocação de magnésio em fogos de artifício, de modo a intensificar seu brilho.
A baixa densidade desse metal (1,738 g.cm-3) o torna um grande atrativo para ligas metálicas. Isso porque ligas com magnésio podem ter uma massa que corresponda a um quarto do aço. Sua metalurgia mais simples também o faz popular nos setores de construção, aeronaves, além de instrumentos ópticos e eletrônicos.
Nos sistemas biológicos, o magnésio tem grande importância, já que ele é vital para que células ou enzimas de organismos vivos possam sintetizar adenosina trifosfato, DNA e RNA. O magnésio é o átomo central da porfirina clorofila, responsável pela fotossíntese.
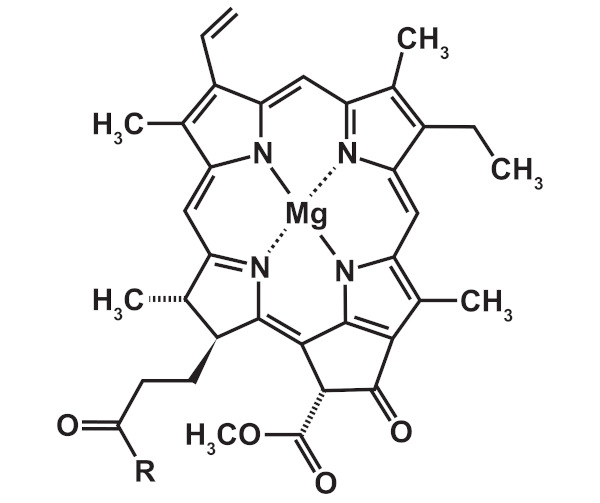
Já na química orgânica, o magnésio foi essencial para os avanços nos estudos dos organometálicos. Embora já se conhecesse compostos organometálicos de magnésio, os que haviam sido descritos até então tinham a questão da baixíssima solubilidade, desacelerando suas aplicações. Até que, em 1900, o então doutorando francês Victor Grignard conseguiu sintetizar compostos organometálicos de magnésio solúveis e estáveis em solução, dando origem ao que hoje conhecemos como compostos de Grignard.
Essa descoberta revolucionou a química orgânica, tanto que Grignard recebeu um prêmio Nobel, em 1912, pela descoberta. Hoje, os compostos de Grignard são os nucleófilos mais populares, com centenas de milhares de publicações científicas a seu respeito.
Leia mais: A química presente nos fogos de artifício
Magnésio para a saúde
Um ser humano adulto deve consumir, em média, 300 mg de magnésio por dia. Há evidências de que a ingestão de magnésio pode reduzir o risco de derrames, insuficiência cardíaca e diabetes tipo 2.
Seu amplo papel celular também é destaque. Estima-se que o magnésio se envolva em mais de 300 reações bioquímicas. O magnésio regula a contração dos músculos, ajuda a formar o ATP e, como antioxidante, auxilia na eliminação de radicais livres, tão danosos à saúde.
O magnésio também auxilia nos efeitos da tensão pré-menstrual (TPM), pois seu controle sobre os músculos ajuda a aplacar as cólicas. Alguns ginecologistas e nutricionistas, inclusive, chegam a suplementar magnésio durante a gestação, de modo a diminuir as contrações uterinas e evitar partos prematuros.
Em nosso corpo, a maior parte do magnésio está armazenada nos ossos. Lá, ele auxilia a fim de evitar a deficiência de vitamina D, tão essencial para a saúde óssea.
O magnésio também é utilizado na fabricação de remédios. O mais famoso é o leite de magnésia, uma suspensão de hidróxido de magnésio utilizada como antiácido e laxante. O citrato de magnésio é aplicado em remédios efervescentes, enquanto o sulfato de magnésio é comercializado sob o nome de sal de Epsom, conhecido por suas propriedades anti-inflamatórias, antioxidantes e relaxantes.

História do magnésio
A palavra magnésio vem de uma expressão latina magnesia alba, que significa “magnésia branca”, nome dado ao carbonato de magnésio. Contudo, entende-se que o nome do elemento teve origem grega, uma vez que Magnésia era um distrito de Tessália, Grécia, local em que foi encontrado o mineral esteatito, um silicato de magnésio hidratado, conhecido como talco ou pedra-sabão.
Embora já se conhecesse compostos de magnésio, como o sal de Epsom, descoberto em 1618 por Henry Wicker, na cidade de Epsom, ao norte do condado de Surrey, Inglaterra, o magnésio só foi obtido na forma pura em 1808, por Sir Humphry Davy. Davy utilizou o mesmo método eletrolítico desenvolvido por Jöns Jakob Berzelius e Magnus Martin Pontin para isolar o sódio, bário, potássio, estrôncio e cálcio, nos anos de 1807 e 1808.
Exercícios sobre magnésio
Questão 1 (UFTM MG)
O magnésio é um elemento empregado na fabricação de fertilizantes e medicamentos. Um de seus principais compostos, o cloreto de magnésio, pode ser obtido da água do mar por meio das seguintes etapas:
I. precipitação como Mg(OH)2;
II. adição de uma solução aquosa concentrada de HCl;
III. evaporação da água e separação do cloreto de magnésio.
A soma dos menores coeficientes estequiométricos inteiros da equação, corretamente balanceada, para reação de formação de cloreto de magnésio descrita, é igual a
A) 4.
B) 6.
C) 7.
D) 8.
E) 9.
Resposta: letra B
A questão descreve a neutralização do hidróxido de magnésio pelo ácido clorídrico, para a então obtenção do cloreto de magnésio anidro após evaporação. A reação descrita pode ser exposta assim:
Mg(OH)2 + 2 HCl → MgCl2 + 2 H2O
Como a neutralização é total, o número de grupamentos hidróxido (OH) deve ser igual ao número de hidrogênios ionizáveis.
Quando nenhum número é escrito antes da substância, é porque o coeficiente estequiométrico é igual a 1. Assim, a soma dos coeficientes é igual a 1 + 2 + 1 + 2, que é igual a 6.
Questão 2 (Colégio Naval, 2017)
A queima do magnésio (Mg) com o gás oxigênio emite uma luz branca (o flash das máquinas fotográficas), resultando no óxido de magnésio (MgO). A equação dessa reação devidamente balanceada é:
A) Mg + O2 → MgO
B) 2 Mg + O2 → 2 MgO
C) 2 Mg + O3 → Mg2O3
D) Mg + O → 2 MgO
E) Mg2 + O2 → Mg2O
Resposta: letra B
O óxido de magnésio, MgO, é obtido pela combustão do magnésio metálico (Mg) por ação do gás oxigênio (O2). Assim, a reação precisa ter a seguinte estrutura:
Mg + O2 → MgO
Agora, balanceando-a corretamente, temos que:
2 Mg + O2 → 2 MgO
Por Stéfano Araújo Novais
Professor de Química

