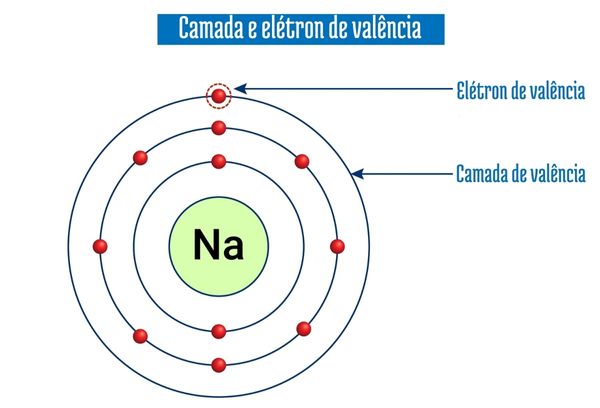
A camada de valência é a camada mais externa do átomo. Os elétrons nela presentes são conhecidos como elétrons de valência. A camada de valência de um átomo é identificada de forma experimental, porém existem ferramentas que podem prevê-la de acordo com a disposição energética mais provável dos elétrons de um átomo.
Essa camada pode ser identificada pela utilização de diagramas, como o de Linus Pauling, que ordena energeticamente os elétrons, e também pela organização dos elementos na Tabela Periódica, já que desde 1913, com a organização da tabela pelos números atômicos dos elementos, os períodos da Tabela Periódica passaram a coincidir com a camada de valência de um átomo.
Tópicos deste artigo
- 1 - Resumo sobre camada de valência
- 2 - Videoaula sobre camada de valência
- 3 - O que é camada de valência?
- 4 - Camadas da eletrosfera
- 5 - Como descobrir a camada de valência?
- 6 - Elétrons na camada de valência
- 7 - Exercícios resolvidos sobre camada de valência
Resumo sobre camada de valência
-
A camada de valência é a camada eletrônica mais externa do átomo.
-
O elétron presente nessa camada é conhecido como elétron de valência.
-
A camada de valência pode ser descoberta pela utilização das técnicas de distribuição eletrônica, utilizando-se o diagrama de Pauling.
-
A organização da Tabela Periódica também pode ser usada para descoberta da camada de valência.
-
O período em que o elemento se encontra na Tabela Periódica coincide com sua camada de valência.
Videoaula sobre camada de valência
O que é camada de valência?
Em Química, define-se como camada de valência a camada eletrônica mais afastada do núcleo do átomo. Embora a camada de valência deva ser identificada experimentalmente, existem ferramentas disponíveis que nos ajudam a prevê-la, como é o caso dos diagramas de energia.
Camadas da eletrosfera
A eletrosfera de um átomo é dividida em camadas, conhecidas como camadas eletrônicas (ou níveis eletrônicos), identificadas pelas letras K, L, M, N, O, P e Q. Essa concepção foi introduzida pelo cientista dinamarquês Niels Bohr, durante o desenvolvimento de seu modelo atômico datado do começo do século XX.
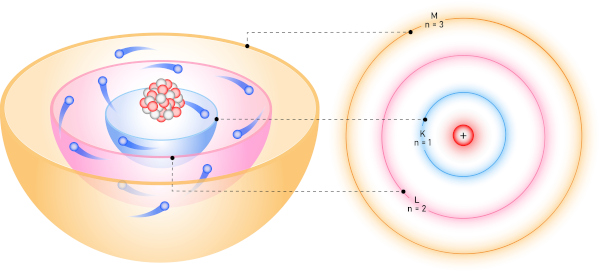
Segundo Bohr, os elétrons estariam dispostos em camadas eletrônicas, mantendo sua energia constante (ou seja, não absorveriam ou emitiriam energia), comportamento não possível de ser explicado pela mecânica clássica, mas sim pelas teorias quânticas que haviam sido recentemente descobertas.
Quanto mais distante estiver essa camada eletrônica do núcleo, maior será a sua energia. O número máximo de elétrons em cada camada (de K até Q) é determinado pela equação de Rydberg:
nº elétrons = 2n2
-
n → nível energético.
Por exemplo, como K é a primeira camada, ela representa o nível energético n = 1 e assim sucessivamente. Porém, até hoje, a equação de Rydberg se distancia do observado experimentalmente a partir da quinta camada:
|
Camada eletrônica |
Número máximo de elétrons |
|
|
Equação de Rydberg |
Experimental |
|
|
K (n = 1) |
2 |
2 |
|
L (n = 2) |
8 |
8 |
|
M (n = 3) |
18 |
18 |
|
N (n = 4) |
32 |
32 |
|
O (n = 5) |
50 |
32 |
|
P (n = 6) |
72 |
18 |
|
Q (n = 7) |
98 |
8 |
Logo após a concepção do modelo de Bohr, percebeu-se que os níveis energéticos eram compostos por subdivisões, as quais ficaram conhecidas como subníveis energéticos. Os subníveis, após um tempo, receberam a designação s, p, d, f, g, h e assim sucessivamente.
Atualmente, os 118 elementos da Tabela Periódica podem ser descritos pelos subníveis:
-
s (que vem do inglês sharp), que suporta até 2 elétrons;
-
p (do inglês principal), que suporta até 6 elétrons;
-
d (do inglês diffusal), que suporta até 10 elétrons;
-
e f (do inglês fundamental), que suporta até 14 elétrons.
Como descobrir a camada de valência?
Há duas formas básicas de descobrir a camada de valência de um átomo: pela sua distribuição eletrônica ou pela Tabela Periódica.
→ Distribuição eletrônica
O diagrama de Linus Pauling (alguns autores também creditam ao cientista Erwin Madelung a concepção do diagrama e também citam as contribuições de Pao-Fang Yi) é uma forma de tentar apresentar a disposição dos elétrons em ordem crescente de energia, ou, melhor dizendo, uma forma preferencial de preenchimento dos elétrons nas camadas. O diagrama é o que se segue:
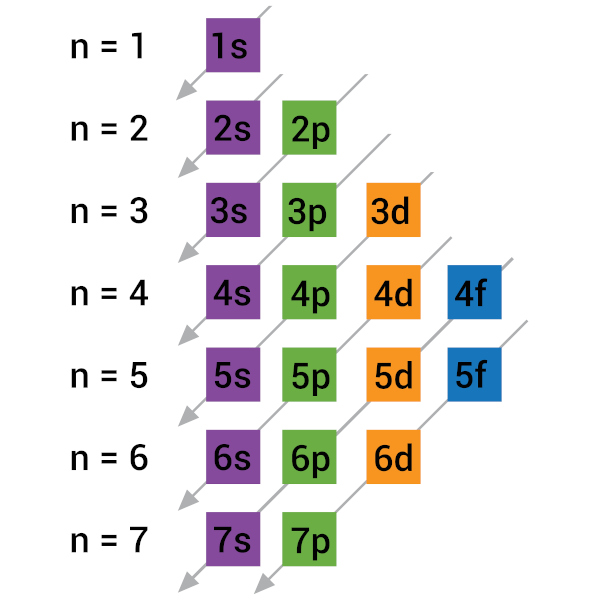
O diagrama é facilmente interpretado: basta seguir as setas diagonais para entender a ordem de preenchimento dos elétrons. Por exemplo, vamos ver o elemento sódio (11Na). Ele possui número atômico 11 e, em seu estado fundamental, possui também 11 elétrons. Sua distribuição é a seguinte:
11Na — 1s2 2s2 2p6 3s1
O número acima e à esquerda representa o número de elétrons. Assim, o sódio possui 2 elétrons em n = 1, 8 elétrons (2 + 6) em n = 2 e 1 elétron em n = 3. O maior nível (também mais externo), que no caso do sódio é n = 3, corresponderá à camada de valência. Assim, a camada de valência do sódio é a camada 3 (camada M), e lá está um elétron (dentro do subnível s).
Elementos de transição possuem um efeito interessante na distribuição eletrônica. Vamos falar no caso do ferro (Fe, Z = 26), que possui 26 elétrons. Sua distribuição é a seguinte:
26Fe — 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Nesse caso, o maior nível é o 4, apesar de o subnível 4s estar entre subníveis do nível 3. Porém, o diagrama de Pauling apresenta a ordem energética, e não a ordem geométrica. Sendo assim, o nível mais externo é o nível 4, por isso é a camada de valência, com os dois elétrons do subnível 4s.
→ Tabela Periódica
Desde 1913, a Tabela Periódica é organizada em ordem crescente dos números atômicos dos elementos. A partir daí, os períodos (que correspondem às linhas da Tabela Periódica) coincidiram com a camada de valência de cada elemento. Assim, é possível determinar a camada de valência do elemento em questão identificando o período em que ele se encontra.
Por exemplo, o elemento carbono (C) encontra-se no segundo período, indicando que a camada n = 2 (camada L) é sua camada de valência. O elemento telúrio (Te) encontra-se no quinto período; assim, é possível concluir que sua camada de valência é a camada n = 5 (camada P).
Elétrons na camada de valência
A melhor forma de identificar os elétrons da camada de valência é por meio da distribuição eletrônica. Vejamos o caso do elemento bromo (Br, Z = 35):
35Br — 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
Sendo a camada n = 4 a maior, ou seja, a mais externa, identificamos 2 subníveis pertencentes a essa camada: os subníveis 4s e 4p. O número de elétrons é indicado pelo número logo acima, à esquerda, ou seja, há 2 elétrons no subnível 4s e 5 elétrons no subnível 4p, totalizando assim 7 elétrons na camada de valência.
Saiba também: O que é a distribuição eletrônica de íons?
Exercícios resolvidos sobre camada de valência
Questão 1
(UCS) Os dias dos carros com luzes azuis estão contados, pois, desde 1º de janeiro de 2009, as lâmpadas de xenônio (Xe) não podem mais ser instaladas em faróis convencionais. Mesmo que as lâmpadas azuis possibilitem três vezes mais luminosidade do que as convencionais, elas não se adaptam adequadamente aos refletores feitos para o uso com lâmpadas convencionais, podendo causar ofuscamento à visão dos motoristas que trafegam em sentido contrário e possibilitando, assim, a ocorrência de acidentes.
Quantos elétrons o gás xenônio apresenta na camada de valência?
A) 2
B) 6
C) 8
D) 10
E) 18
Resolução:
Alternativa C
O elemento xenônio possui número atômico 54 e, no estado fundamental, possui também 54 elétrons. Assim, sua distribuição eletrônica é a que se segue:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
O nível mais externo é o nível 5, contendo os subníveis 5s, com 2 elétrons, e 5p, com 6 elétrons. Assim, existem 8 elétrons na camada de valência do xenônio.
Questão 2
(IFSP) O número de elétrons da camada de valência do átomo de cálcio (Z = 20), no estado fundamental, é
A) 1
B) 2
C) 6
D) 8
E) 10
Resolução:
Alternativa B
O cálcio, com Z = 20, possui 20 elétrons em seu estado fundamental. Assim, sua distribuição eletrônica é:
1s2 2s2 2p6 3s2 3p6 4s2
Sendo o nível 4 o mais externo, o subnível 4s é o único pertencente ao quarto nível. Assim, há 2 elétrons na camada de valência para o cálcio.
Por Stéfano Araújo Novais
Professor de Química