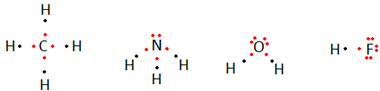O químico norte-americano Gilbert N. Lewis (1875-1946) propôs a regra do octeto, que diz:
“Os átomos de diferentes elementos estabelecem ligações químicas, doando, recebendo ou compartilhando elétrons, a fim de adquirirem a configuração eletrônica de gás nobre, isto é, com 8 elétrons na última camada (ou com 2 elétrons no caso daqueles átomos que possuem apenas uma camada eletrônica, como ocorre com o hidrogênio).”
Em 1916, Lewis sugeriu que para ficarem estáveis, atingindo o octeto ou o dueto, os elementos que compõem as substâncias moleculares realizam um compartilhamento de pares de elétrons. Essas substâncias são formadas apenas por átomos de hidrogênio, ametais e semimetais, todos com a tendência de receber elétrons. Por isso, não tem como nenhum deles doar algum elétron (como ocorre com os metais nas ligações iônicas), mas todos precisam receber, de modo que compartilhem seus elétrons por meio de uma ligação covalente ou molecular.
Assim, Gilbert Lewis propôs uma forma de representar a ligação covalente ou molecular, que ficou sendo conhecida como fórmula de Lewis. Ela também é chamada de fórmula eletrônica ou, ainda, fórmula eletrônica de Lewis, porque a sua principal característica é que ela mostra os elétrons na camada de valência de cada átomo e a formação dos pares eletrônicos.
Cada elétron é representado por um ponto, que fica ao redor do símbolo do elemento químico correspondente. Apenas os elétrons da camada de valência é que ficam ao redor do elemento.
Como mostra a tabela abaixo, para sabermos a quantidade de elétrons da camada de valência, basta saber a família da Tabela Periódica:

Na fórmula de Lewis, cada par de elétrons compartilhado representa uma ligação química (covalente), em que os elétrons se encontram na região da eletrosfera que é comum a cada par de átomos que estão unidos. Por isso, na representação, eles são colocados lado a lado.
Por exemplo, vamos descobrir qual é a fórmula de Lewis para o gás hidrogênio, cuja fórmula molecular é: H2.
Cada átomo de hidrogênio possui apenas um elétron na camada de valência, pois esse elemento pertence à família 1 da Tabela Periódica. Cada um precisa receber mais um elétron, para ficar estável, com dois elétrons na camada eletrônica K. Assim, eles compartilham seus elétrons e ambos ficam com dois. Veja:
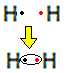
Essa é a fórmula eletrônica de Lewis da molécula de gás hidrogênio.
O oxigênio possui seis elétrons na sua camada eletrônica, assim cada um precisa receber mais dois elétrons para ficar estável, com oito elétrons. Por isso, a fórmula eletrônica de Lewis da molécula de gás oxigênio é:
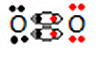
Veja que são duas ligações, pois há dois pares compartilhados.
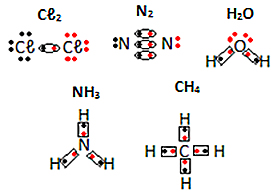
Veja outros exemplos de fórmulas eletrônicas de substâncias moleculares abaixo:
Por Jennifer Fogaça
Graduada em Química