A cinética química é uma subárea da Química que estuda a velocidade das reações químicas, bem como mecanismos para seu controle. É por meio do estudo da cinética que se desenvolvem modelos matemáticos para entender a velocidade de consumo de um reagente ou de geração de um produto em uma reação química.
O estudo da cinética química permite que saibamos os fatores capazes de alterar a velocidade de uma reação química, seja para torná-la mais rápida ou então mais lenta. A compreensão desse campo é essencial para o desenvolvimento de diversas áreas industriais, como a farmacêutica, a de petróleo e gás, a automotiva, entre outras.
Leia também: Estequiometria — a subárea da Química que estuda as relações entre reagentes e produtos nas reações químicas
Tópicos deste artigo
- 1 - Resumo sobre cinética química
- 2 - Videoaula sobre cinética química
- 3 - O que é cinética química?
- 4 - O que a cinética química estuda?
- 5 - Velocidade das reações químicas
- 6 - Teoria das colisões
- 7 - Fatores que alteram a velocidade da reação química
- 8 - Importância da cinética química
- 9 - Exercícios resolvidos sobre cinética química
Resumo sobre cinética química
-
A cinética química é uma área da Físico-Química que estuda a velocidade dos processos químicos, bem como mecanismos de controle para tal.
-
A velocidade de uma reação química tem relação com a quantidade de reagente consumido ou de produto gerado em um determinado intervalo de tempo.
-
É comum estabelecer modelos de estudo de velocidade por meio da velocidade inicial de consumo de reagente.
-
A cinética química busca, por meio da teoria das colisões, explicar as condições necessárias para a ocorrência de uma reação química.
Não pare agora... Tem mais depois da publicidade ;) -
Entre os mecanismos de controle para a velocidade de uma reação química estão os fatores capazes de alterar a velocidade da reação química: a concentração, a temperatura, a superfície de contato e o catalisador.
-
Catalisadores são substâncias químicas que diminuem a energia de ativação da reação química ao estabelecer uma nova rota reacional no meio. Ao fim, não são consumidos, já que são regenerados.
-
A cinética química é importante para campos diversos, como para a indústria farmacêutica.
Videoaula sobre cinética química
O que é cinética química?
Cinética química é a área da Química, mais especificamente da Físico-Química, que se preocupa em estudar e compreender a velocidade com que as reações químicas ocorrem e suas formas de controle.
O que a cinética química estuda?
A cinética química estuda a velocidade com que se desenvolve uma reação química, bem como os fatores capazes de controlar a progressão de uma reação, seja para retardá-la, seja para acelerá-la.
Essa área da Físico-Química existe porque a Termodinâmica, apesar de ser muito importante para os sistemas químicos, não possui apenas a capacidade de determinar se um processo químico é espontâneo ou não.
Alguns processos, mesmo sendo termodinamicamente favoráveis (ou seja, espontâneos), praticamente não ocorrem, como é o caso da decomposição do benzeno em carbono e hidrogênio, por exemplo. Isso tudo porque a Termodinâmica não estuda ou prevê os detalhes da progressão de um processo químico, algo que é competência da área de cinética química.
Velocidade das reações químicas
Em geral, a velocidade é definida como a variação de uma propriedade dentro de um intervalo de tempo. Na Física, por exemplo, mede-se velocidade quando se afere a variação da posição de um corpo, ou seja, qual a distância percorrida dentro de um intervalo de tempo. Em Química, de forma distinta, a velocidade de uma reação química avalia a variação da concentração de um participante, seja reagente ou produto, dentro de um intervalo de tempo.
→ Velocidade média da reação química
É bem verdade que a velocidade de consumo de um reagente (R) ou de geração de produto (P) muda com o tempo, e, por isso, é interessante que se trabalhe com a velocidade média da reação química (Vm), calculada da seguinte forma:
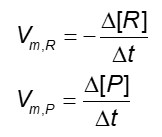
Perceba que a velocidade média para o reagente possui um sinal negativo antes. Isso porque como o reagente é consumido, a variação da concentração é negativa, e como não se admitem valores negativos para a velocidade, deve-se incluir o sinal para correção.
Dentro de uma reação química, contudo, os reagentes e produtos são consumidos ou gerados mediante uma proporção estequiométrica. Por exemplo, na reação de síntese da amônia:
N2 + 3 H2 ⇌ 2 NH3
O gás hidrogênio é consumido com o triplo da velocidade que o gás nitrogênio, pois a proporção estequiométrica é de 1 para 3 entre esses reagentes. Assim, a velocidade média de gás nitrogênio em relação ao gás hidrogênio é:
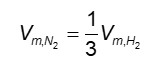
Dessa forma, é possível estabelecer uma velocidade média única para qualquer reação. No exemplo anterior, essa velocidade média única é:
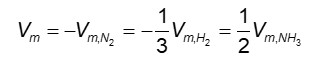
→ Lei da velocidade
Uma das principais formas de estudo da tendência da velocidade de uma reação química é por meio das velocidades iniciais. Isso porque no início de uma reação química, a concentração dos produtos é igual a zero. Dessa forma, pode-se excluir a interferência dos produtos na velocidade da reação, simplificando o entendimento e os cálculos. Observe, a seguir, uma reação hipotética:
AB → A + B
Experimentalmente, sabe-se que quanto maior a concentração inicial do reagente, maior a velocidade de consumo deste. Assim, pode-se dizer que:
Velocidade inicial de consumo de AB ∝ inicial
O símbolo ∝ significa “proporcional a”. Para retirar a proporcionalidade e transformar essa leitura em uma igualdade, usa-se uma constante de proporcionalidade, conhecida como constante de velocidade, representada pela letra k:
Velocidade inicial de consumo de AB = k ∙
A constante k é exclusiva de cada reação, ou seja, ela varia de acordo com o processo químico estudado. Em um mesmo processo químico, o valor de k só se altera com a mudança da temperatura em que a reação química ocorre. Perceba que a variação da concentração de AB em função da velocidade inicial de consumo é uma equação de primeiro grau, ou seja, uma relação linear.
Porém, para alguns processos químicos, essa relação pode ser qualquer uma — como, por exemplo, quadrática, cúbica ou simplesmente sem relação. Ou seja, a velocidade de consumo é constante e só depende do valor de k. Então, de modo geral, uma lei de velocidade para um processo químico com n reagentes (R) pode ser escrita como:
Velocidade = k ∙ [R1]a ∙ [R2]b ∙ ... ∙ [Rn]n
Os expoentes são conhecidos como “ordem” e podem ser qualquer número inteiro positivo, além do 0 — ou seja, 0, 1, 2, 3 e assim sucessivamente —, não necessariamente diferentes um do outro, podendo ser iguais também.
As ordens de cada reagente são determinadas experimentalmente, mediante a avaliação das velocidades em situações diversas. Contudo, em dois casos é possível determinar o valor dessas ordens de maneira direta: quando a reação ocorre em uma única etapa (chamada de reação elementar) ou quando a etapa lenta da reação química é conhecida. Nesses casos, a ordem é numericamente igual aos coeficientes estequiométricos da equação química.
A seguir, veja um exemplo em relação a uma reação elementar:
2 NO2 → 2 NO + O2
A expressão da velocidade é então v = k ∙ [NO2] 2.
A seguir, veja um exemplo de etapa lenta da reação:
A reação química 2 H2 + 2 NO → N2 + H2O ocorre em duas etapas, sendo a 1ª etapa a mais lenta.
1ª etapa: H2 + 2 NO → N2O + H2O (lenta)
2ª etapa: H2 + N2O → N2 + H2O (rápida)
Nesse caso, a lei de velocidade é dada por:
v = k ∙ [H2] ∙ 2
Teoria das colisões
A teoria das colisões é um modelo para descrever como ocorrem reações químicas em nível molecular. Segundo essa teoria, as reações químicas só podem ocorrer se as partículas dos reagentes se encontrarem, colidindo entre si. É interessante pensar que as partículas podem ser consideradas como bolas de bilhar.
Contudo, nem toda colisão necessariamente implica uma reação química. Para que esta seja efetiva, dois fatores devem ser considerados: a geometria das colisões e também a energia cinética das colisões.
A geometria de uma colisão diz respeito à orientação das colisões, ou seja, se as moléculas se chocarão no ângulo correto. Imagine a seguinte reação:
H2 + I2 → 2 HI
A seguir, representamos, com esferas, as moléculas de H2 e I2 reagindo entre si.
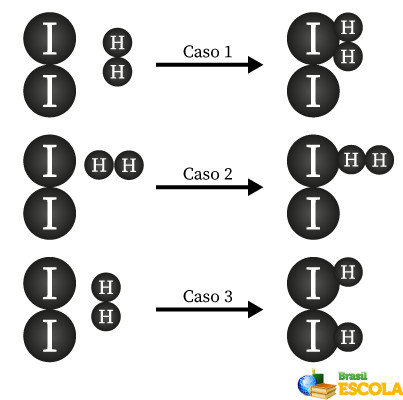
Repare que nem no caso I nem no caso II as colisões ocorrem com o ângulo adequado, não permitindo a formação de iodeto de hidrogênio, HI. Já no caso III, a colisão (lateral) ocorre de forma correta, permitindo a formação dos produtos.
Para que uma colisão desencadeie uma reação química, é necessário que ela tenha uma energia cinética mínima. Ou seja, nem toda colisão, mesmo com orientação adequada, resulta em uma reação. Essa energia cinética mínima de colisão é conhecida como energia de ativação, ou seja, o gatilho energético para uma reação química.
Cada processo reacional tem sua energia de ativação. Em um gráfico da variação de entalpia de uma reação química é possível extrair informações acerca da energia de ativação:
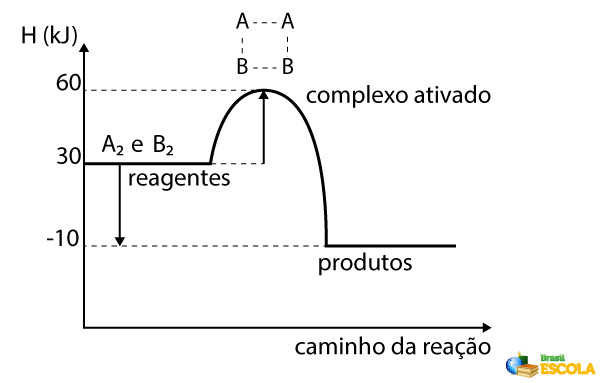
A energia de ativação, no gráfico, é a distância energética dos reagentes até o ponto mais alto do gráfico, conhecido como complexo ativado. Nesse caso, para que A2 e B2 reajam para formar 2 mols de AB, é necessário que as colisões tenham uma energia cinética mínima de 30 kJ (60 – 30, conforme visto no gráfico). Caso as moléculas de AB queiram se decompor em A2 e B2 novamente, elas devem colidir a uma energia cinética mínima de 70 kJ (60 - (-10), conforme visto no gráfico).
O complexo ativado é um estado transitório e teórico de uma reação química. Admite-se que é nesse ponto que as ligações químicas dos reagentes são desfeitas para se criar as ligações químicas dos produtos.
Perceba então que quanto maior a energia de ativação, mais lento será o processo. Se a energia cinética mínima da colisão for baixa, a frequência de colisões que atingem essa energia necessária é maior.
Fatores que alteram a velocidade da reação química
As reações químicas podem ter sua taxa de conversão alterada mediante alterações de alguns parâmetros, sendo os principais a concentração dos reagentes, a temperatura do sistema, a superfície de contato e os catalisadores.
→ Concentração dos reagentes
No que diz respeito à concentração, devemos lembrar que a lei da velocidade de uma reação química é diretamente proporcional ao produto das concentrações dos reagentes, em mol.L-1. Por exemplo, para uma reação hipotética, que ocorre em uma única etapa, temos:
x A + y B → AxBy
A expressão da velocidade para essa reação é:
v = k ∙ x ∙ y
Assim, quanto maiores forem as concentrações de A e B, maior será a velocidade da reação química, uma vez que são linearmente proporcionais.
→ Temperatura
A temperatura é também um importante fator de regulação cinética. É preciso lembrar que a temperatura é a medida da energia cinética de um corpo, sendo esta calculada como:
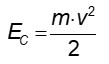
Logo, quanto maior a temperatura, maior a energia cinética, e quanto maior a energia cinética, maior a velocidade das partículas (observe que há uma dependência quadrática). Assim, quanto mais velozes estiverem as partículas, mais frequentes e vigorosas serão as colisões entre elas, propiciando assim que os choques superem a energia de ativação da reação química mais facilmente e com maior frequência.
É por isso que os alimentos são estocados em baixa temperatura para aumentar seu tempo de conservação, por exemplo. Quando colocamos alimentos na geladeira, as reações químicas responsáveis pela deterioração são desaceleradas pela queda da temperatura.

→ Superfície de contato
A superfície de contato tem relação com o número de partículas disponíveis para a reação química. Por exemplo, ao dissolver um comprimido efeverscente inteiro, percebe-se um maior tempo de dissolução quando se compara o mesmo processo com o comprimido triturado. Isso se dá porque no comprimido triturado, mais partículas estão participando do processo, ou seja, há uma maior superfície de contato entre os participantes do sistema.
Assim, quanto maior a superfície de contato, mais partículas estão presentes para participar do processo químico, o que aumenta a velocidade do processo.
No processo de reciclagem do alumínio, por exemplo, deve-se diminuir a superfície de contato durante a fusão do metal, já que ele é facilmente oxidado pelo ar em altas temperaturas, e se pulverizado, o metal é transformado em óxido de alumínio. Por isso, os materiais de alumínio que serão reciclados são prensados em blocos, de modo a diminuir o contato do metal com o ar atmosférico (que contém cerca de 20% de gás oxigênio).

→ Catalisadores
Os catalisadores são substâncias muito desejadas em processos químicos, já que aumentam a velocidade da reação química sem ser consumidos. Isso permite que poucas quantidades de catalisador sejam empregadas no processo.
Quimicamente, o catalisador fornece uma rota reacional de menor energia de ativação, explicando o porquê de ele ser capaz de acelerar os processos. O catalisador, inicialmente, liga-se ao reagente, o qual desenvolve a reação pela nova rota reacional de menor energia propiciada pelo catalisador. Quando o produto é então formado, o catalisador é quimicamente regenerado, demonstrando o porquê de não ser consumido.
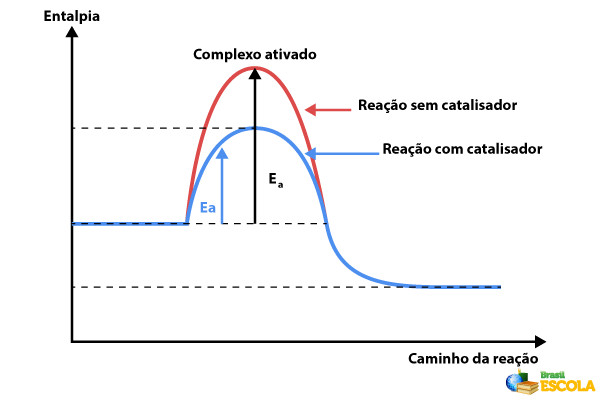
Os catalisadores, entretanto, não têm capacidade de alterar o equilíbrio químico, já que aceleram, na mesma proporção, tanto a reação direta quanto a reação inversa. Existem os catalisadores homogêneos, que são aqueles que estão na mesma fase dos reagentes — como, por exemplo, catalisadores gasosos em reações entre gases. Há também os catalisadores heterogêneos, que são aqueles que estão em uma fase distinta dos reagentes. Um exemplo são os catalisadores sólidos que estão finamente divididos no meio reacional.
As enzimas são importantes catalisadores do nosso corpo, permitindo que as reações químicas que ocorram em nosso organismo sejam mais rápidas.
Importância da cinética química
Sem dúvida alguma, o conhecimento da velocidade de uma reação química é imprescindível para nossa sociedade. Já citadas anteriormente, as geladeiras permitem que consigamos estocar alimentos por mais tempo, reduzindo assim a perda e o custo deles.
Na indústria, hoje, dificilmente um processo não conta com um catalisador. O ramo de catálise é um dos mais importantes da Química, pois se busca, cada vez mais, catalisadores mais baratos, duráveis e seletivos.
O estudo da cinética química também contribuiu para o desenvolvimento do air bag, dispositivo de segurança obrigatório nos carros atuais, consistindo em uma bolsa que infla em milésimos de segundos após a colisão do veículo. Essa bolsa é estufada rapidamente por conta da decomposição da azida de sódio. Tal decomposição é acionada por um sensor de colisão, que gera uma faísca e desencadeia a seguinte reação, a qual produz gás N2, que infla as bolsas:
2 NaN3 + → 2 Na + 3 N2

Na Farmácia, o estudo cinético é imprescindível ao desenvolvimento de medicamentos. Um remédio pode ser desenvolvido, por exemplo, para ser metabolizado mais lentamente ou mais rapidamente. Por isso, diversas formas de administração podem ser utilizadas, como líquidos, comprimidos, cápsulas ou mesmo compostos intravenosos.
Imagine um paciente que está com uma tremenda crise de enxaqueca. Para ele, deve ser administrado um medicamento que alivie o mais rápido possível os sintomas da crise, de forma distinta de um paciente que faz uso de medicamentos diários, cuja liberação costuma ser lenta.
Foi também o estudo da cinética que permitiu calcular em quanto tempo materiais se deterioram na natureza, como vidros, metais e plásticos.
Além disso, os estudos e modelos cinéticos possibilitam as datações de fósseis e múmias egípcias.
Esses são apenas alguns exemplos de como a cinética química está presente em nosso dia a dia, influenciando a nossa relação com o mundo.
Saiba mais: Eletroquímica — a subárea da Química que estuda as pilhas, as baterias e as eletrólises
Exercícios resolvidos sobre cinética química
Questão 1
(Enem)
O sulfeto de mercúrio (II) foi usado como pigmento vermelho para pinturas de quadros e murais. Esse pigmento, conhecido como vermilion, escurece com o passar dos anos, fenômeno cuja origem é alvo de pesquisas. Aventou-se a hipótese de que o vermilion seja decomposto sob a ação da luz, produzindo uma fina camada de mercúrio metálico na superfície. Essa reação seria catalisada por íon cloreto presente na umidade do ar.
WOGAN, T. Mercury's Dark Influence on Art. Disponível em: www.chemistryworld.com. Acesso em: 26 abr. 2018 (adaptado)
Segundo a hipótese proposta, o íon cloreto atua na decomposição fotoquímica do vermilion:
A) reagindo como agente oxidante.
B) deslocando o equilíbrio químico.
C) diminuindo a energia de ativação.
D) precipitando cloreto de mercúrio.
E) absorvendo a energia da luz visível.
Resolução:
Alternativa C
O íon cloreto, segundo o enunciado, catalisa a reação. Sendo um catalisador, a função do íon cloreto é apresentar uma nova rota reacional com menor energia de ativação, o que acelera o processo químico.
Questão 2
(Enem) A nanotecnologia pode ser caracterizada quando os compostos estão na ordem de milionésimos de milímetros, como na utilização de nanomateriais catalíticos nos processos industriais. O uso desses materiais aumenta a eficiência da produção, consome menos energia e gera menores quantidades de resíduos. O sucesso dessa aplicação tecnológica muitas vezes está relacionado ao aumento da velocidade da reação química envolvida.
O êxito da aplicação dessa tecnologia é por causa da realização de reações químicas que ocorrem em condições de
A) alta pressão.
B) alta temperatura.
C) excesso de reagentes.
D) maior superfície de contato.
E) elevada energia de ativação.
Resolução:
Alternativa D
O êxito do processo está no fato de se colocar compostos na ordem de milionésimos de milímetros. Nesse contexto, a superfície de contato, ou seja, a quantidade de moléculas participando do processo no mesmo intervalo de tempo, aumenta.
A maior eficiência de produção também consome menos energia e gera menores quantidades de resíduos, fatores que dispensam condições de alta pressão, alta temperatura, excesso de reagentes e elevada energia de ativação.
Por Stéfano Araújo Novais
Professor de Química

