Estequiometria é uma forma de relacionar quantidades de reagentes que reagem entre si ou quantidades de produtos que são formados em um processo reacional particular. A estequiometria é utilizada, portanto, para prever quantidades de reagentes que serão utilizados ou de produtos que serão formados em processos químicos.
A estequiometria se baseia nas leis ponderais, mais especificamente nas leis elaboradas por Lavoisier e por Proust. Existem diversas metodologias para a realização dos cálculos da estequiometria, os quais exigem intenso estudo para compreensão. É um dos temas mais abordados nas provas de vestibulares do Brasil e figura entre um dos principais temas da prova do Enem.
Leia também: Oxirredução — um processo químico em que há transferência de elétrons entre elementos de uma reação química
Tópicos deste artigo
- 1 - Resumo sobre estequiometria
- 2 - Videoaula sobre estequiometria
- 3 - O que é estequiometria?
- 4 - Leis da estequiometria
- 5 - Como fazer cálculos estequiométricos?
- 6 - Qual a importância da estequiometria?
- 7 - Estequiometria no Enem
- 8 - Exercícios resolvidos sobre estequiometria
Resumo sobre estequiometria
- A estequiometria é uma forma de relacionar as quantidades de substâncias que reagem entre si ou as quantidades de produtos que são originados em um processo químico específico.
- A estequiometria é baseada em leis ponderais, principalmente as desenvolvidas por Lavoisier e por Proust.
- Os cálculos estequiométricos são de grande auxílio para a Química, pois ajuda a prever quantidades de reagentes que serão utilizados ou de produtos que serão formados.
- Existem diversas metodologias para os cálculos da estequiometria, necessitando-se de muito estudo para sua total compreensão.
- Os passos que adotaremos neste texto para realizar os cálculos estequiométricos são os seguintes:
- Balancear a reação química.
- Identificar as substâncias a serem trabalhadas.
- Montar a regras de três.
- Converter as unidades.
- Calcular a regra de três.
- Estequiometria é um dos temas mais cobrados nas provas de vestibulares do Brasil e é um dos principais temas da prova de Ciências da Natureza do Enem.
Videoaula sobre estequiometria
O que é estequiometria?
A estequiometria é uma forma de relacionar as quantidades de substâncias que reagem entre si em uma reação química específica, bem como as quantidades de produtos que são formadas em uma reação química específica.
Considere a equação química a seguir:
a A + b B → c C
A partir dela, a estequiometria nos informa que um número de “a” mols da substância A reage com um número de “b” mols da substância B para formar um número de “c” mols da substância C.
As letras “a”, “b” e “c” são conhecidas como coeficientes (ou índices) estequiométricos e servem para indicar a proporção mínima e inteira, em quantidade de matéria (mols), em que os participantes do processo químico reagem entre si.
Leis da estequiometria
Os processos químicos e a estequiometria são regidos por leis, conhecidas como leis ponderais: a lei de Lavoisier (lei da conservação de massas) e a lei de Proust (lei das proporções fixas). Entenda sobre cada uma delas a seguir.
-
Lei de Lavoisier (lei da conservação de massas)
A lei de Lavoisier (lei da conservação de massas) foi anunciada pelo químico francês Antoine Lavoisier em 1785 e diz que a soma das massas dos reagentes é sempre igual à soma das massas dos produtos. Contudo, tal máxima só é perceptível experimentalmente se a reação química ocorrer em sistemas fechados.
-
Lei de Proust (lei das proporções fixas)
A lei de Proust (lei das proporções fixas) foi anunciada pelo químico Joseph Louis Proust em 1797 e diz que uma determinada substância, qualquer que seja a sua origem, é sempre formada pelos mesmos elementos químicos (mesma composição química), combinados na mesma proporção em massa.
Como fazer cálculos estequiométricos?
A realização de cálculos estequiométricos pode ser feita a partir de diferentes métodos, motivo pelo qual é comum que o aluno evidencie diferenças a depender do professor. Contudo, de forma geral, todos precisam seguir algumas regras básicas. A seguir, veremos o passo a passo de como fazer um cálculo estequiométrico.
Para isso, vamos utilizar o seguinte exemplo:
O processo industrial para a síntese da amônia é conhecido como Processo Haber-Bosch. Nele, os gases nitrogênio e hidrogênio reagem, em condições específicas de temperatura e pressão, para a produção de NH3, conforme reação a seguir não balanceada:
N2 (g) + H2 (g) → NH3 (g)
Supondo que sejam utilizados 14 kg N2 em uma planta industrial, qual a massa de NH3 produzida?
Dados: MMN = 14 g.mol–1; MMH = 1 g.mol–1
-
1º passo: balancear a reação química
Antes de começar a fazer um exercício de estequiometria, é essencial que a reação química esteja balanceada. Ao balancear uma reação química, garantimos que as quantidades, em mol (e, por consequência, em massa), dos participantes seja constante ao longo do processo químico, garantindo a lei de Lavoisier.
Basicamente, para se balancear, devemos alterar os coeficientes estequiométricos dos participantes, de modo que a quantidade dos elementos nos reagentes e nos produtos seja a mesma. Para fazer o balanceamento, existem algumas técnicas, sendo a principal o método das tentativas, que consiste em alterar os coeficientes, por meio de tentativas sucessivas (tentativa e erro), até que tudo fique acertado.
Uma das formas de se direcionar o método das tentativas é utilizar uma regra empírica, conhecida como regra do MACHO, que diz que devemos balancear os elementos na seguinte ordem: Metais, Ametais, Carbono, Hidrogênio e, por fim, o Oxigênio.
Na reação do exercício, temos apenas dois elementos: nitrogênio (ametal) e hidrogênio.
Antes da seta, nos reagentes, temos o nitrogênio na forma de N2, contabilizando dois nitrogênios no lado dos reagentes. Após a seta, no NH3, há apenas um único nitrogênio. O número 3, ali presente, só faz referência ao hidrogênio. Assim sendo, devemos colocar o número 2 na frente do NH3:
N2 + H2 → 2 NH3
Repare que nunca devemos alterar os números subscritos (que estão embaixo), pois isso configuraria alteração da composição química (ou seja, da substância). O balanceamento só permite alteração dos coeficientes estequiométricos.
Após o balanceamento do nitrogênio (ametal), o hidrogênio, após a seta, fica com seis unidades, pois o coeficiente 2, à frente, multiplica não só o nitrogênio, como também o hidrogênio. Como havia três hidrogênios, multiplicando-se por dois, o total agora é de seis hidrogênios nos produtos (após a seta). Para se ter a mesma quantidade de hidrogênios antes da seta (nos reagentes), devemos utilizar o coeficiente estequiométrico 3, de modo a também atingir seis hidrogênios:
N2 + 3 H2 → 2 NH3
Assim, podemos garantir que toda a reação química está balanceada.
-
2º passo: identificar as substâncias a serem trabalhadas
A estequiometria sempre busca relacionar quantidades que irão reagir entre si. Contudo, para prever uma quantidade desconhecida que será produzida ou consumida, devemos ter como base uma informação conhecida de consumo ou de produção.
Ao se observar o enunciado, vê-se que o objetivo é determinar a massa de NH3 (uma informação desconhecida) a partir de 14 kg de N2 (uma informação conhecida). Sendo assim, utilizaremos as duas substâncias para trabalhar a estequiometria.
-
3º passo: montar a regras de três
As substâncias possuem proporções definidas e se combinam sempre na mesma proporção. Ou seja, existe uma proporção fixa de reação química que é demonstrada quantitativamente pela equação química balanceada. Os cálculos que envolvem essas proporções devem utilizar metodologias de cálculo que trabalhem, obviamente, a proporção. Em estequiometria, o principal método de cálculo para proporção é a regra de três.
Na regra de três, existem duas colunas (uma será de cada participante) e duas linhas. A primeira linha da regra de três deverá ser preenchida com informações da reação química, ou seja, apresentar a proporção de reação básica entre os participantes, em mols. Já a segunda linha da regra de três deverá ser preenchida com as informações que se deseja relacionar, ou seja, o que se possui de informação e o que se quer de informação, elementos que podem ser retirados do enunciado do exercício. A regra de três montada fica assim:

-
4º passo: converter as unidades
A regra de três montada até agora é matematicamente operável, contudo, suponha que coloquemos a seguinte expressão:
1 ⋅ x = 2 ⋅ 14
Se afirmarmos que x é igual a 28 kg de NH3, cometeremos um grande equívoco químico: caso fosse verdade, a massa molar de N2 seria igual à massa molar de NH3, o que é sabido que não é verdade. Ou seja, não existe proporcionalidade entre número de mols e de massa de substâncias diferentes.
Por isso, para respeitar os parâmetros químicos, a regra de três deve estar padronizada com a mesma unidade: ou toda em mols, ou toda em massa. No caso do exercício em questão, como estamos interessados na massa de NH3 produzida, convém converter todos os valores para massa, de modo que o valor de x já seja obtido em unidade de massa. De toda forma, não é errado converter toda a regra de três para unidade de mols, apenas será necessária uma etapa a mais para converter x de mol para massa.
A conversão de mol para massa (ou de massa para mol) é feita por meio da massa molar (a quantidade de gramas presente em 1 mol de uma entidade elementar, tal como um átomo, uma molécula, um íon...).
Cada mol de átomos de nitrogênio possui 14 g.mol-1, assim sendo, para o N2, a massa molar é calculada como:
MM (N2) = 2 ⋅ 14 = 28 g ⋅ mol-1
Já para o NH3, reutilizaremos a massa molar de nitrogênio, com o acréscimo da massa molar de hidrogênio, que é igual a 1 g.mol-1:
MM (NH3) = 14 + (3 ⋅ 1) = 17 g ⋅ mol-1
Convertida, a regra de três fica:

Repare que 17 gramas é referente a 1 mol de NH3. Como há dois mols na regra de três, utilizaremos o dobro.
-
5º passo: calcular a regra de três
Com a regra de três padronizada, já é possível calculá-la:

Repare que a primeira linha está em unidade de gramas, enquanto a segunda linha está em quilogramas. Não há problema em operar assim, pois grama e quilogramas são unidades proporcionais. O único cuidado é que x, como está na linha de quilogramas, será obtido em quilogramas.
Assim:
28 ⋅ x = 14 ⋅ 2 ⋅ 17
x = 17 kg NH3
Assim sendo, são obtidos 17 kg de NH3 no processo descrito.
Qual a importância da estequiometria?
A estequiometria tem uma importância ímpar para a indústria química. Os cálculos estequiométricos auxiliam cientistas e engenheiros a predizerem quantidades que serão produzidas ou utilizadas nos mais diversos processos químicos. Os cálculos poderão prever, inclusive, se determinada produção é viável economicamente ou não.
Em projetos de pesquisa, a estequiometria auxilia os químicos a predizerem as quantidades esperadas em reações até então não muito conhecidas e que estão sendo aprimoradas. A partir delas, é possível mensurar rendimentos e ajustar os parâmetros para aperfeiçoá-las.
Todo e qualquer produto químico na indústria é produzido baseado em cálculos estequiométricos. Aliás, não se entra em um laboratório ou em uma planta industrial sem ter noção das quantidades de reagentes que serão utilizados.
Saiba mais: Cálculos estequiométricos no Enem — como resolver de forma simples
Estequiometria no Enem
Estequiometria é um dos temas mais clássicos das provas de vestibular e não seria diferente com o Enem (Exame Nacional do Ensino Médio). Observando a Matriz de Referência, no campo dos “Objetos do conhecimento associados às Matrizes de Referência”, percebemos que, dentro de Ciências de Natureza, percebe-se um campo específico para os cálculos químicos:
Representação das transformações químicas - Fórmulas químicas. Balanceamento de equações químicas. Aspectos quantitativos das transformações químicas. Leis ponderais das reações químicas. Determinação de fórmulas químicas. Grandezas Químicas: massa, volume, mol, massa molar, constante de Avogadro. Cálculos estequiométricos.
Exercícios resolvidos sobre estequiometria
Questão 1
(Enem) Um marceneiro esqueceu um pacote de pregos ao relento, expostos à umidade do ar e à chuva. Com isso, os pregos de ferro, que tinham a massa de 5,6 g cada, acabaram cobertos por uma camada espessa de ferrugem (Fe₂O₃⋅H₂O), uma substância marrom insolúvel, produto da oxidação do ferro metálico, que ocorre segundo a equação química:

Considere as massas molares (g/mol): H = 1; O = 16; Fe = 56.
Qual foi a massa de ferrugem produzida ao se oxidar a metade (50%) de um prego?
A) 4,45 g.
B) 8,90 g.
C) 17,80 g.
D) 72,00 g.
E) 144,00 g.
Resolução:
Alternativa A.
Se apenas 50% do ferro foi oxidado, então não devemos considerar sua massa total (5,6 gramas), mas apenas metade dela, que é igual a 2,8 gramas.
A estequiometria ocorrerá entre o Fe e a ferrugem (Fe₂O₃⋅H₂O)
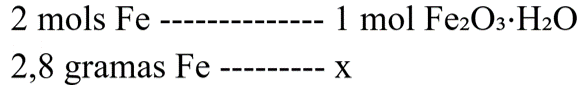
Como é desejado saber a massa de ferrugem produzida, devemos converter toda a regra de três para unidade de massa. A massa molar do Fe é igual a 56 g/mol, já a de Fe₂O₃⋅H₂O é calculada como sendo a massa de Fe₂O₃ + H₂O, ou seja:
MM (Fe2O3) = 2.56 + 3.16 = 112 + 48 = 160 g/mol
MM (H2O) = 2.1 + 16 = 18 g/mol
Logo, MM (Fe₂O₃⋅H₂O) = 160 + 18 = 178 g/mol
A regra de três convertida fica:
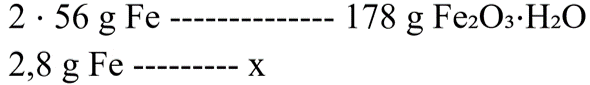
Fazendo-se a conta, tem-se que:
2 ⋅ 56 ⋅ x = 2,8 ⋅ 178
x = 4,45 gramas de Fe₂O₃⋅H₂O
Questão 2
(Enem) O carvão é um combustível que tem várias substâncias em sua composição. Em razão disso, quando é representada sua queima com o oxigênio (massa molar 16 g mol−1), simplifica-se elaborando apenas a combustão completa do carbono (massa molar 12 g mol−1). De acordo com o conteúdo médio de carbono fixo, o carvão é classificado em vários tipos, com destaque para o antracito, que apresenta, em média, 90% de carbono. Esse elevado conteúdo favorece energeticamente a combustão, no entanto, libera maior quantidade de gás que provoca efeito estufa.
Supondo a queima completa de 100 g de carvão antracito, a massa de gás liberada na atmosfera é, em grama, mais próxima de
A) 90,0.
B) 210,0.
C) 233,3.
D) 330,0.
E) 366,7.
Resolução:
Alternativa D.
Neste caso, a reação química não foi dada, sendo assim, por ser a combustão do carvão, feito de carbono (C), podemos dizer que é:
C + O2 → CO2
E, por coincidência, a reação já está balanceada.
Devemos considerar não 100 gramas de carvão antracito, mas apenas 90% dele, pois este é o teor de carbono no carvão antracito. Assim, utilizaremos 90 gramas de carbono para os cálculos.
O gás liberado é o CO2, e, assim sendo, calcularemos sua massa:

Convertendo-se a regra de três para unidades de massa, temos a massa molar de C como 12 g.mol-1, já a de CO2 será:
MM (CO2) = 12 + 2.16 = 44 g.mol-1
Assim, a regra de três fica:

Calculando-se:
12 ⋅ x = 90 ⋅ 44
x = 330 gramas de CO2.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. Glossary of terms used in physical organic chemistry. Pure and Applied Chemistry, Reino Unido, 1994.
Por Stéfano Araújo Novais
Professor de Química









