No texto “Como atuam as substâncias catalisadoras?” , foi mostrado que os catalisadores conseguem aumentar a velocidade das reações porque eles diminuem a energia de ativação necessária para a ocorrência da reação. Eles fazem isso por mudar o mecanismo da reação, combinando-se com os reagentes e formando um composto intermediário que, por usa vez, transforma-se nos produtos e no catalisador.
Uma das formas para que isso ocorra chama-se Catálise Homogênea, que é quando o catalisador forma com os reagentes um sistema monofásico.
Isso significa que os reagentes, os produtos e o catalisador precisam estar todos na mesma fase, isto é, no mesmo estado físico.
O estudo desse tipo de catálise é importante para a ciência e para a indústria, pois diversas reações importantes para a produção podem ser aceleradas com quantidades pequenas de catalisadores.
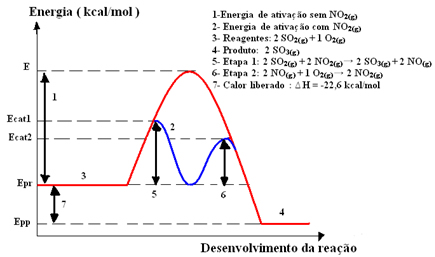
Um exemplo de catálise homogênea utilizada na indústria é uma etapa intermediária na fabricação de ácido sulfúrico (H2SO4(aq)), em que ocorre a formação do trióxido de enxofre (SO3(g)) por meio da reação de combustão do dióxido de enxofre (SO2(g)), mostrada a seguir:
2 SO2(g) + O2(g) → 2 SO3(g)
Essa reação se processa de modo demasiadamente lento, assim, é adicionado um catalisador, o dióxido de nitrogênio (NO2(g)). Esse catalisador se combina com o dióxido de enxofre formando um composto intermediário (complexo ativado), que é o monóxido de nitrogênio (NO(g)).
Depois, esse composto intermediário reage com o gás oxigênio (O2(g)) para a regeneração do catalisador. Veja a seguir como isso ocorre e observe como todos estão na fase gasosa, formando um meio homogêneo:
catalisador complexo ativado
Etapa 1: 2 SO2(g) + 2 NO2(g)→ 2 SO3(g) + 2 NO(g)
Etapa 2: 2 NO(g)+ 1 O2(g) → 2 NO2 (g)
Reação Global: 2 SO2(g) + O2(g) → 2 SO3(g)
Veja que o catalisador só participa das etapas intermediárias, mas não é consumido. Ao final da reação, ele é totalmente recuperado. A reação com esse mecanismo feito em duas etapas necessita de menos energia de ativação para ocorrer e, por isso, ela se processa mais rapidamente.
Representação gráfica:
Por Jennifer Fogaça
Graduada em Química

