Conforme explicado no texto “Catálise e Catalisador”, os catalisadores são espécies químicas que aceleram a velocidade das reações. O seu uso é muito útil em indústrias químicas, onde se procura ganhar o máximo de tempo possível na produção.
No entanto, em determinadas situações é mais interessante que a reação se processe de forma mais lenta; como, por exemplo, quando se quer determinar a velocidade de reações muito rápidas. Para conseguir tal façanha, controlando e estudando essas reações, costuma-se adicionar uma substância que torna as reações mais lentas, que são denominadas inibidores, venenos ou anticatalisadores.
Essas espécies químicas se combinam com o catalisador, anulando ou diminuindo sua ação. Isso é possível porque o mecanismo de ação do catalisador é diminuir a energia de ativação, facilitando o processo da reação e aumentando sua velocidade; já os inibidores agem de modo inverso, o que significa que eles aumentam a energia de ativação necessária para os reagentes atingirem o complexo ativado.
Um exemplo que pode ser mencionado é o arsênico (As), que tem essa função na reação de Haber-Bosch, reação bastante feita na indústria para a produção da amônia, utilizando o ferro (Fe(s)) como seu catalisador. Assim, a eficiência do ferro se torna muito pequena na presença do arsênico, que o inibe, ou seja, é o veneno de catalisador dessa reação, que está mostrada abaixo:
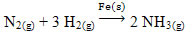
O arsênico também pode exercer uma ação anticatalítica quando se usa platina metálica (Pt(s)) como catalisador da reação de combustão do SO2(g), para a produção de trióxido de enxofre (SO3(g)). A presença do arsênico, mesmo em pequenas quantidades, anula a ação catalítica da platina, podendo paralisar parte da produção. É por isso que, normalmente, em indústrias que tratam dessa produção, usa-se o pentóxido de divanádio (V2O5(s)) como catalisador no lugar da platina.
Outro exemplo ocorre na reação de decomposição da água oxigenada a seguir:
2 H2O2(aq) → 2 H2O(l) + 1 O2(g)
Nesse caso, um inibidor que pode ser usado é algum ácido, pois quando o meio está ácido, a reação se processa de forma mais lenta.
Mas o inibidor também é muito aproveitado pela indústria, principalmente para agir como retardador de reações da degradação natural de alimentos, bebidas, cosméticos e remédios.
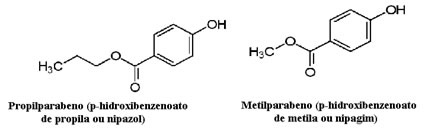
Os cosméticos, por exemplo, podem demorar muito tempo para chegar às mãos do consumidor; assim, são usados vários conservantes neles, tais como o propilparabeno, que é utilizado na fase oleosa e atua como antifúngico, e o metilparabeno, usado em fase aquosa e que tem efeito antisséptico. Suas respectivas estruturas estão mostradas abaixo:
É interessante que em muitos rótulos de cosméticos há a seguinte frase: “Não contém parabenos”. Isso quer dizer que tal cosmético não possui esses conservantes que citamos e que, normalmente, não foram testados em animais.
Por Jennifer Fogaça
Graduada em Química
