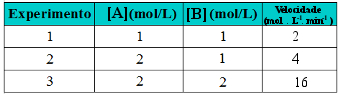
A ordem de uma reação química é a relação matemática que existe entre a taxa de desenvolvimento ou velocidade da reação e a concentração em quantidade de matéria dos reagentes.
Por exemplo, consideremos a reação não elementar abordada no texto Lei da velocidade para reações não elementares:
CO + NO2 → CO2 + NO
A lei da velocidade dessa reação é dada por:
v = k . [NO2]2
Temos que, nesse caso, a ordem global dessa reação será igual a 2, a ordem da reação em relação ao reagente NO2 também será igual a 2 e, em relação ao reagente CO, será igual a zero.
Chegamos a essa conclusão porque a ordem da reação global é a soma dos expoentes das concentrações dos reagentes na lei da velocidade e a ordem da reação em relação a um determinado reagente é o expoente de sua concentração na lei da velocidade.
Por exemplo, considere que temos a seguinte reação genérica:
aA + bB → cC + dD
Sendo que a lei da velocidade dessa reação é:
v = k . α. β
Dizemos que essa reação genérica é de:
- Ordem α em relação a A;
- Ordem β em relação a B;
α + β = ordem global da reação
Veja mais dois exemplos:
1) Reação elementar: 2 CO(g) + O2(g)→ 2 CO2(g)
Como é uma reação elementar, o expoente na lei da velocidade é igual ao coeficiente do reagente: v = k . 2. [O2]1
Assim, temos que essa reação é de ordem 2 em relação ao CO, de ordem 1 em relação ao O2 e sua ordem global é 3 (2 + 1 = 3).
2) Reação não elementar: 2 H2(g) + 2 NO(g)→ 1 N2(g) + H2O(g)
As etapas dessa reação são dadas por:
Etapa 1 (lenta): 1 H2(g) + 2 NO(g) → 1 N2Og) + 2 H2O(l)
Etapa 2 (rápida): 1 N2Og) + 2 H2O(l) → 1 N2(g) + 2 H2O(l)
Equação global:2 H2(g) + 2 NO(g) → 1 N2(g) + 2 H2O(l)
Os expoentes na lei da velocidade são dados pelos coeficientes dos reagentes na etapa lenta: v = k [H2]1. 2.
Essa reação é de 1ª ordem em relação ao H2, de 2ª ordem em relação ao NO e de 3ª ordem em relação à reação global (soma dos expoentes: 1+2 = 3).
Uma observação importante é que existem algumas reações que ocorrem na superfície de metais que são de ordem zero, porque a velocidade não depende da concentração dos reagentes.
Por Jennifer Fogaça
Graduada em Química