A energia de ativação é a quantidade mínima de energia necessária para que a colisão entre as partículas dos reagentes, feita em uma orientação favorável, seja feita e resulte em reação.
As reações só ocorrem quando os reagentes possuem energia de ativação (ou energia mínima necessária, que varia de reação para reação; tanto na quantidade como na forma) ou quando ela é fornecida a eles.
Por exemplo, quando o sódio metálico entra em contato com a água, ele reage violentamente. Isso significa que o conteúdo de energia desses reagentes já é suficiente para a reação ocorrer.
Já no caso de ligarmos um fogareiro, a reação de combustão só ocorrerá se colocarmos um palito de fósforo aceso ou alguma outra fonte de fogo perto do gás que está sendo liberado pelo fogareiro. Isso significa que, nesse caso, foi necessário fornecer energia ao sistema para que ele atingisse a energia de ativação e a reação ocorresse.
No caso do próprio fósforo utilizado, para que ele entre em combustão, a energia de ativação é fornecida pelo atrito. O mesmo ocorre com os isqueiros, que também precisam de uma faísca que dê a energia de ativação necessária para a combustão do gás contido em seu interior.
A energia de ativação pode também ser fornecida pela luz, como é o caso da decomposição da água oxigenada. É por isso que ela é guardada em frascos escuros ou opacos.

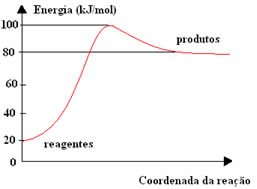
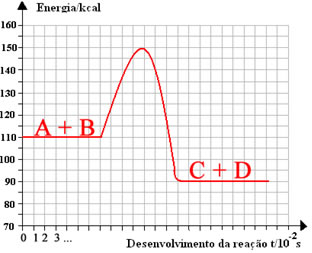
Dessa forma, podemos concluir que a energia de ativação (Eat) é a diferença entre a energia necessária para que a reação tenha início (E) e a energia própria contida nos reagentes (Epr):

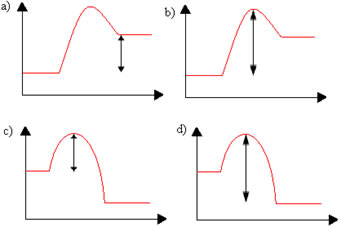
A energia de ativação é um obstáculo para que a reação ocorra e ela é necessária para romper as ligações dos reagentes. Com isso, a reação ocorre e novas ligações são feitas para a formação dos produtos.
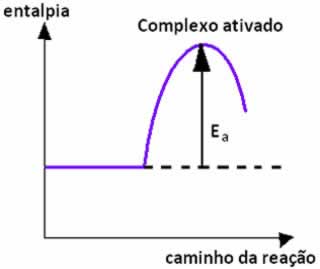
Quando a colisão entre as partículas dos reagentes com orientação favorável ocorre com energia igual ou superior à energia de ativação, antes da formação dos produtos, forma-se um estado intermediário e instável, denominado complexo ativado, em que as ligações dos reagentes estão enfraquecidas e as ligações dos produtos estão sendo formadas. Assim, a energia de ativação é a energia necessária para formar o complexo ativado.
Abaixo temos um gráfico que mostra a energia de ativação como uma barreira para a efetivação da reação:
Por Jennifer Fogaça
Graduada em Química