A ação de um catalisador é basicamente acelerar o desenvolvimento de uma determinada reação. Isso é possível porque o catalisador muda o mecanismo com que a reação se processa, levando a um “caminho alternativo” que exige uma menor energia de ativação para que a reação inicie e atinja o complexo ativado.
Existem diversos tipos de catálise, sendo que uma delas é a catálise heterogênea, que pode ser definida como aquela que ocorre quando o sistema apresenta mais de uma fase, ou seja, os reagentes e os produtos encontram-se num estado físico diferente do estado físico do catalisador.
Um exemplo que podemos citar é uma etapa intermediária de formação do ácido sulfúrico (H2SO4(aq)). Essa etapa consiste na formação do trióxido de enxofre (SO3(g)) por meio da reação de combustão do dióxido de enxofre (SO2(g)):
2 SO2(g) + O2(g) → 2 SO3(g)
Como essa reação ocorre de modo lento, usa-se um catalisador para acelerá-la. Um catalisador que pode ser usado nesse caso é o pentóxido de divanádio (V2O5(S)), que é sólido. Visto que os reagentes e o produto da reação são gasosos, teremos um sistema heterogêneo.
Mas, como o pentóxido de divanádio consegue acelerar a reação?
O que acontece é que as moléculas do reagente oxigênio são adsorvidas, isto é, retidas na superfície do pentóxido de divanádio. Isso faz com que as ligações das moléculas desse gás se enfraqueçam com o tempo, o que facilita a formação do complexo ativado e, consequentemente, diminui a energia de ativação da reação, aumentando sua taxa de desenvolvimento, ou seja, sua velocidade.
Veja no esquema a seguir como isso ocorre:
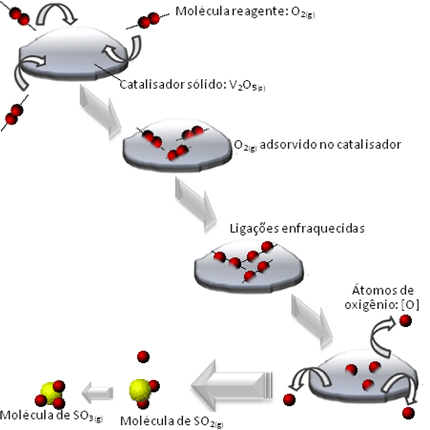
Outros exemplos de catálises heterogêneas estão mostrados abaixo. Observe que em ambos os casos os reagentes e os produtos estão nos estados gasosos, aquoso ou líquido, enquanto que os catalisadores se encontram no estado sólido:
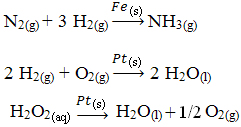
Um exemplo de catálise heterogênea que ocorre em nosso cotidiano é a dos conversores catalíticos dos automóveis, mais conhecidos como catalisadores. Esses dispositivos antipoluição são recobertos por substâncias que atuam como catalisadores, sendo geralmente uma liga de paládio e ródio (para motores a gasolina) e de paládio e molibdênio (para motores a álcool).
Dentro desse catalisador ocorrem reações químicas nas quais os gases provenientes da combustão incompleta, que são mais prejudiciais para o ser humano, são convertidos em gases não tóxicos. Os reagentes e os produtos são todos os gases, enquanto que os catalisadores são sólidos.
Para entender mais a respeito do sistema de funcionamento desse equipamento, leia o texto: “Conversor Catalítico”.
Por Jennifer Fogaça
Graduada em Química

